
分析 某温度(t℃)时,测得0.01mol•L-1的NaOH溶液的pH=11,据此计算离子积常数;将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合,若所得混合液为中性说明氢离子和氢氧根离子物质的量相同,据此列式计算;
解答 解:某温度(t℃)时,测得0.01mol•L-1的NaOH溶液的pH=11,据此计算离子积常数Kw=c(OH-)×c(H+)=0.01mol/L×10-11mol/L=10-13(mol/L),
将pH=a的NaOH溶液Va L与pH=b的硫酸Vb L混合,若所得混合溶液为中性,且a=12,b=2,所得混合液为中性说明氢离子和氢氧根离子物质的量相同,
则:10-2×Vb=$\frac{1{0}^{-13}}{1{0}^{-12}}$×Va,整理可得Va:Vb=1:10,
故答案为:1:10.
点评 本题考查了溶液酸碱性与溶液pH的计算,题目难度中等,正确计算该温度下水的离子积为解答关键,注意掌握溶液酸碱性与溶液pH的关系,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 相同温度下,1 mol•L-1氨水与0.5 mol•L-1氨水中c(OH-)之比是2:1 | |
| B. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)═2c(H+)+c(CH3COOH) | |
| C. | 向0.2 mol•L-1 NaHCO3溶液中加入等体积0.1 mol•L-1 NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | CH3COOH是弱电解质,NH3•H2O是弱电解质,故CH3COONH4也是弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
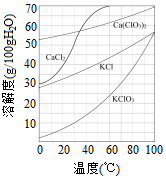 工业上制取氯酸钾的主要步骤为:
工业上制取氯酸钾的主要步骤为:查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
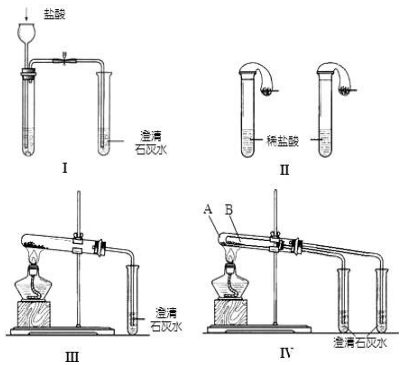
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,3-二甲基-2-乙基己烷 | B. | CH3CH2CH2Cl氯丙烷 | ||
| C. |  属于芳香醇 属于芳香醇 | D. |  属于芳香化合物 属于芳香化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验现象 | ⑦ | ③ | ||
| 实验结论 | ⑥ | ① |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
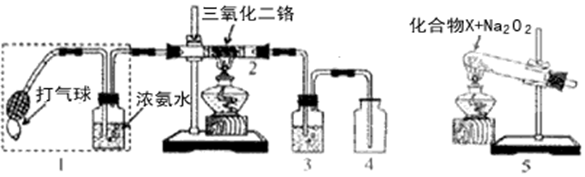
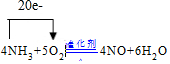 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铍的原子失电子能力比镁弱 | B. | 砹(At)的氢化物不稳定 | ||
| C. | 硒的原子半径比硫小 | D. | Sr(OH)2 比Ca(OH)2 碱性强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com