
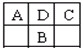
 A、B、C、D为短周期元素,在周期表中如图所示:A、C两种元素的原子核外电子数之和等于B原子的核电荷数.有关说法不正确的是( )
A、B、C、D为短周期元素,在周期表中如图所示:A、C两种元素的原子核外电子数之和等于B原子的核电荷数.有关说法不正确的是( )| A、A的氧化物有多种形式 |
| B、B的最高价氧化物对应的水化物是一种强酸 |
| C、D元素形成的单质不止一种 |
| D、C的氢化物水溶液通常用玻璃试剂瓶盛放 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
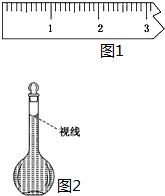 实验室需要配制0.50mol/L NaCl溶液480mL.按下列操作步骤填上适当的文字,以使整个操作完整.
实验室需要配制0.50mol/L NaCl溶液480mL.按下列操作步骤填上适当的文字,以使整个操作完整.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铊是易导电的银白色金属 |
| B、Tl(OH)3是两性氢氧化物 |
| C、能生成+3价离子化合物 |
| D、Tl3+的氧化能力比Al3+强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 信息 |
| X | K层电子数是L层电子数的2倍 |
| Y | 一种核素在考古时常用来鉴定一些文物的年代 |
| Z | 所处的周期序数与族序数相等 |
| W | 最高价氧化物对应的水化物酸性最强 |
| A、W的阴离子半径大于Z的阳离子半径 |
| B、Y的氢化物比W的氢化物稳定 |
| C、Z的最高价氧化物对应的水化物不能够溶于Y的最高价氧化物对应的水化物 |
| D、X在氧气中加热反应生成X2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定没有CO2,肯定有H2 |
| B、一定有CO、CO2和水蒸气? |
| C、一定有H2、CO2和HCl |
| D、可能有CO2、NH3和水蒸气? |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①和②分子中碳原子数大于10 |
| B、①和②常温常压下不为气态 |
| C、①和②均能与Na反应放出氢气 |
| D、②的分子式为C12H24O |
查看答案和解析>>
科目:高中化学 来源: 题型:
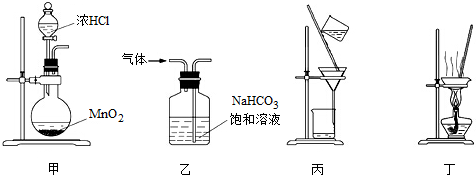
| A、用装置甲制取氯气 |
| B、用装置乙除去氯气中混有的少量氯化氢 |
| C、用装置丙分离二氧化锰和氯化锰溶液 |
| D、用装置丁蒸干氯化锰溶液制MnCl2?4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
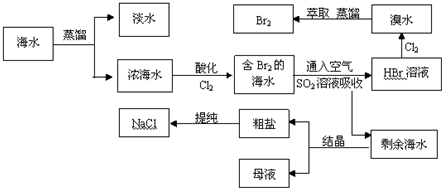
查看答案和解析>>
科目:高中化学 来源: 题型:
 化合物AX3和单质X2在一定条件下反应可生成化合物AX5.回答下列问题;
化合物AX3和单质X2在一定条件下反应可生成化合物AX5.回答下列问题;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com