
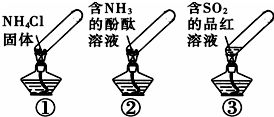
 “封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是( )
“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是( )| A. | 加热时,①上部汇集了固体NH4Cl,说明NH4Cl的热稳定性比较好 | |
| B. | 加热时,②溶液褪色或红色变浅,冷却后又都变为红色 | |
| C. | 加热时,③溶液褪色或红色变浅,冷却后又都变为红色 | |
| D. | 三个“封管实验”中所发生的化学反应都是可逆反应 |
分析 A.氯化铵不稳定,受热易分解,分解生成的氨气遇冷重新反应生成氯化铵;
B.加热时氨气逸出,②中颜色为无色,冷却后氨气溶解②中为红色;
C.依据二氧化硫的漂白原理和漂白效果不稳定性解答;
D.可逆反应应在同一条件下进行.
解答 解:A.加热时,①上部汇集了固体NH4Cl,是由于氯化铵不稳定,受热易分解,分解生成的氨气遇冷重新反应生成氯化铵,故A错误;
B.加热时氨气逸出,②中颜色为无色,冷却后氨气溶解②中为红色,故B正确;
C.二氧化硫与有机色素化合生成无色物质而具有漂白性,受热又分解,恢复颜色,所以加热时,③溶液变红,冷却后又变为无色,故C错误;
D.可逆反应应在同一条件下进行,题中实验分别在加热条件下和冷却后进行,不是可逆反应,故D错误.
故选B.
点评 本题以“封管实验”为载体,考查了可逆反应、漂白性、平衡移动的因素、氯化铵的性质等知识,为高频考点,侧重于学生的分析能力的考查,注意相关基础知识的积累,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 一定有SO42- | B. | 一定有CO32- | ||
| C. | 不能确定Cl-是否存在 | D. | 不能确定SO42- 是否存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
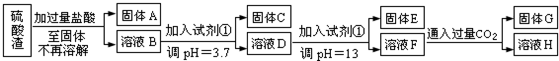
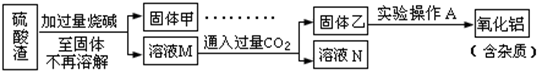
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 要求处理垃圾,但是又极力反对建造垃圾焚烧处理厂行为 | |
| B. | 夏天盖着被子吹空调 | |
| C. | 尽量购买本地的、当季的食物,减少食物的加工过程 | |
| D. | 开着5.6L排量的汽车直播声讨北京的雾霾天气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,1mol白磷中含有共价键为4NA | |
| B. | 标准状况下,22.4L甲醇完全燃烧产生NA个CO2分子 | |
| C. | 常温常压下,46g NO2、N2O4混合物中,分子数为NA | |
| D. | 常温常压下,32g的O2 和32g的O3 所含的氧原子个数均为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com