
| 实验目的 | 试剂(或条件) | |
| A | 温度对H2O2分解反应速率的影响 | ①热水浴②冰水浴 |
| B | 用稀硫酸比较铝和铁的金属活动性 | ①铝粉 ②铁钉 |
| C | 用酸化的AgNO3溶液检验海水中Cl-能否蒸馏除去 | ①海水 ②蒸馏所得液体 |
| D | 用Na块检验乙醇分子存在不同于烃分子里的氢原子 | ①乙醇 ②煤油 |

| A. | A | B. | B | C. | C | D. | D |
分析 A.只有温度一个变量;
B.铝和铁为不同金属,且铝粉接触面积大;
C.蒸馏水中不含氯离子,则加硝酸银不生成沉淀;
D.钠与煤油不反应,Na与乙醇反应生成氢气.
解答 解:A.只有温度一个变量,则图装置可完成温度对H2O2分解反应速率的影响,故A正确;
B.铝和铁为不同金属,且铝粉接触面积大,该实验中多个变量,不能探究金属的活动性,故B错误;
C.蒸馏水中不含氯离子,则加硝酸银不生成沉淀,则图装置可用酸化的AgNO3溶液检验海水中Cl-能否蒸馏除去,故C正确;
D.钠与煤油不反应,Na与乙醇反应生成氢气,则图中装置可用Na块检验乙醇分子存在不同于烃分子里的氢原子,故D正确;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及反应速率影响因素、离子检验及有机物的结构确定等,把握化学反应原理、物质的性质及探究实验能力等为解答的关键,侧重分析与实验能力的综合考查,注意实验的评价性分析及速率测定中控制变量法应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
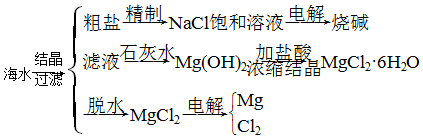
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熵减的吸热反应可能是自发反应 | |
| B. | 需要加热的化学反应,生成物的总能量一定高于反应物的总能量 | |
| C. | 使用催化剂既不会改变反应的限度又不会改变反应的焓变 | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 比较非金属性强弱:Si弱于C,C弱于S | |
| B. | 用四氯化碳提取碘水中的碘单质 | |
| C. | 观察烧碱的焰色反应 | |
| D. | 比较NaHCO3和Na2CO3的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶解 | |
| B. | 可用加热氯化铵分解的方法制取氨气 | |
| C. | 在BaCl2溶液中通入SO2气体会产生白色沉淀 | |
| D. | 向某无色溶液中加入AgNO3溶液,产生白色沉淀,再加入稀盐酸,沉淀不消失,则该无色溶液中可能含有Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
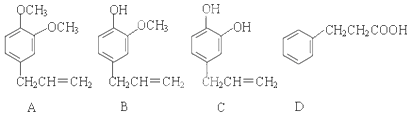

 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在1.0L密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0 容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )
在1.0L密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0 容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )| A. | 从反应开始到t1时的平均反应速率v(X)=$\frac{0.2}{{t}_{1}}$mol/(L•min) | |
| B. | 该温度下此反应的平衡常数K=0.32 | |
| C. | 欲提高平衡体系中Y的含量,可升高体系温度或减少Z的量 | |
| D. | 其他条件不变,再充入0.1 mol 气体X,平衡正向移动,X的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com