
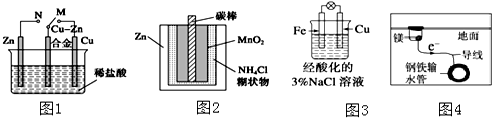
| A. | 图1中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小 | |
| B. | 图2中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 | |
| C. | 图3中,滴加少量K3[Fe(CN)6]溶液,没有蓝色沉淀出现 | |
| D. | 图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极 |
分析 A、开关由M改置于N时,Zn为负极,合金为正极;
B、图2中,正极上得电子发生还原反应,体现氧化作用;
C、该装置构成原电池,铁作负极,负极上铁失电子发生氧化反应;
D、牺牲阳极的阴极保护法中,作负极的金属易被腐蚀.
解答 解:A、开关由M改置于N时,合金为正极,则Cu-Zn合金被保护,腐蚀速率减小,故A正确;
B、图2中,该原电池中锌作负极,二氧化锰作正极,正极上得电子发生还原反应,所以Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的,故B错误;
C、该装置构成原电池,铁作负极,负极上发生的电极反应式为:Fe-2e-=Fe2+,铁氰化钾和亚铁离子反应生成蓝色沉淀,故C错误;
D、用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁作负极而易被腐蚀,铁作正极被保护,故D错误;
故选A.
点评 本题综合考查电化学知识,侧重于金属的腐蚀与防护以及原电池的工作原理的考查,题目难度不大,注意把握电极反应.


科目:高中化学 来源: 题型:选择题
| A. | B的氢化物和E的氢化物能反应,且得到的产物只含有共价键 | |
| B. | C在元素周期表中的位置是第三周期第ⅠA族 | |
| C. | 五种原子中E的原子半径最大 | |
| D. | A的最低价氢化物的沸点>B的最低价氢化物的沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在c(HCO3-)=0.1mol/L的溶液中:NH4+、Al3+、Cl-、NO3- | |
| B. | 无色溶液中:Fe3+、K+、Cl-、H+ | |
| C. | 在pH=12的溶液中:SO32-、CO32-、Na+、K+ | |
| D. | 加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在2Al+2NaOH+2H2O═2NaAlO2+3H2反应中,水和氢氧化钠均作氧化剂 | |
| B. | Al分别于盐酸和氢氧化钠溶液反应,生成等质量的H2,转移的电子数相同 | |
| C. | CO2与Na2O2反应中,每生成1molO2,转移4mol电子 | |
| D. | 在Cu2S+4H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+S↓+SO2↑+4H2O反应中,被氧化的元素只有硫 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化性(酸性溶液):Co(OH)3>FeCl3>I2 | B. | 还原性(碱性溶液):I2>Fe(OH)2>KIO3 | ||
| C. | 热稳定性:NaCl>NaClO4>NaClO | D. | 酸性(水溶液):HSCN>H2CO3>HCN |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第三周期非金属元素氧化物水化物的酸性从左到右依次增强 | |
| B. | 水加热到很高的温度都难以分解是因为水分子间存在氢键 | |
| C. | 同主族元素从上到下,单质的熔点逐渐降低 | |
| D. | 元素的种类由核内质子数决定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.24g | B. | 3.36g | C. | 5.60g | D. | 10.08g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com