
| 1 |
| 3 |
| 1 |
| 3 |
| 13.44L |
| 22.4L/mol |
| 1.8mol |
| 2mol/L |
| 40.32L |
| 22.4L/mol |
| 40.32L |
| 22.4L/mol |


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
| A、0.5 mol/(L?min) |
| B、0.1 mol/(L?min) |
| C、0.2 mol/(L?min) |
| D、0.3 mol/(L?min) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
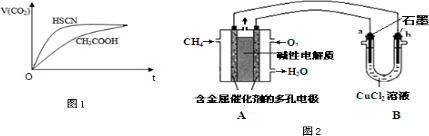
查看答案和解析>>
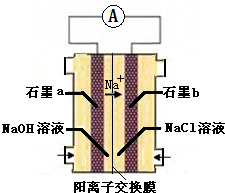
科目:高中化学 来源: 题型:
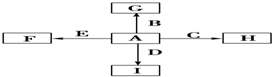
 A、B、C、D是中学化学常见的四种物质,它们的转化关系如下:A+B=C+D
A、B、C、D是中学化学常见的四种物质,它们的转化关系如下:A+B=C+D 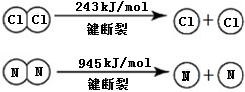 断开1mol H-N键与断开1mol H-Cl键所需能量相差约为
断开1mol H-N键与断开1mol H-Cl键所需能量相差约为查看答案和解析>>
科目:高中化学 来源: 题型:
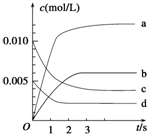 在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:
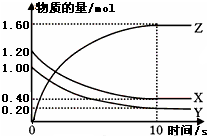 (1)某温度下,2L恒容密闭容器中,X、Y、Z三种气体发生化学反应时,物质的量随时间变化的关系曲线如图所示,则
(1)某温度下,2L恒容密闭容器中,X、Y、Z三种气体发生化学反应时,物质的量随时间变化的关系曲线如图所示,则查看答案和解析>>
科目:高中化学 来源: 题型:
| A、澄清石灰水,浓H2SO4 |
| B、KMnO4酸性溶液,浓H2SO4 |
| C、浓H2SO4,KMnO4酸性溶液 |
| D、溴水,烧碱溶液,浓硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com