
分析 (1)①Na2CO3•10H2O(s)═Na2CO3(s)+10H2O(g)△H1=+532.36kJ•mol-1
②Na2CO3•10H2O(s)═Na2CO3•H2O(s)+9H2O(g)△H2=+373.6kJ•mol-1
③H2O(g)=H2O(l)△H3=-44kJ•mol-1
由盖斯定律①-②+③得到:Na2CO3•2H2O(s)═Na2CO3(s)+2H2O(l),据此进行分析;
(2)表示燃烧热的热化学方程式中可燃物为1mol,产物为稳定氧化物;依据1g乙醇完全燃烧生成CO2和液态水时放热29.7kJ,结合燃烧热的定义计算求出1mol乙醇完全燃烧放出的热量,然后写出热化学方程式.
解答 解:(1)①Na2CO3•10H2O(s)═Na2CO3(s)+10H2O(g)△H1=+532.36kJ•mol-1
②Na2CO3•10H2O(s)═Na2CO3•H2O(s)+9H2O(g)△H2=+373.6kJ•mol-1
③H2O(g)=H2O(l)△H3=-44kJ•mol-1
由盖斯定律①-②+③得到:Na2CO3•2H2O(s)═Na2CO3(s)+2H2O(l)△H=+70.8KJ/mol,
故答案为:Na2CO3•2H2O(s)═Na2CO3(s)+2H2O(l)△H=+70.8KJ/mol;
(2)燃烧热是指:在25℃、101KPa时,1mol纯净物完全燃烧生成稳定的氧化物放出的热量,1g乙醇完全燃烧生成CO2和液态水时放热29.7kJ,则1mol乙醇,质量为46g,完全燃烧生成稳定的氧化物放出的热量为46×29.7kJ=1366.2kJ,其燃烧热的热化学方程式为C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1366.2kJ•mol-1,
故答案为:C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1366.2kJ•mol-1.
点评 本题考查了热化学方程式的书写和盖斯定律的计算应用,题目较简单.


科目:高中化学 来源: 题型:选择题
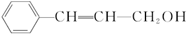 ,则对该有机物的说法正确的是( )
,则对该有机物的说法正确的是( )| A. | 能使溴水、酸性高锰酸钾溶液褪色 | |
| B. | 分子中所有原子在同一平面内 | |
| C. | 分子式为C9H12O | |
| D. | 能发生加成反应、酯化反应、水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的种类由最外层电子数决定 | |
| B. | 化学键是存在于分子、原子和离子间的作用力 | |
| C. | 原子的种类由原子核内质子数与中子数共同决定 | |
| D. | 化学反应速率可以决定反应的限度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Se的原子序数为 24 | |
| B. | Se的氢化物的还原性比硫化氢气体强 | |
| C. | Se的非金属性比Br强 | |
| D. | Se的最高价氧化物分子式为:SeO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,则下列物质与
,则下列物质与  互为同分异构体的是( )
互为同分异构体的是( )| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
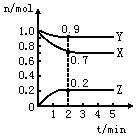 某温度时,在2L密闭容器中X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L密闭容器中X、Y、Z三种物质的量随时间的变化曲线如图所示. 2Z.
2Z.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X单质可以把Y从其氢化物中置换出来 | |
| B. | X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强 | |
| C. | 与H2化合时X单质比Y单质容易 | |
| D. | X原子的最外层电子数比Y原子的最外层电子数多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | C | H2 | CO |
| △H(kJ/mol) | -393.5 | -285.8 | -283.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com