

分析 钡泥主要含BaCO3、BaSO3、Ba(FeO2)2等,加入硝酸,在a容器中充分溶解,可生成硫酸钡,过滤后滤液中含有铁离子、钡离子等,且溶液呈酸性,可加入碳酸钡,调节溶液pH=4~5,使铁离子水解生成Fe(OH)3沉淀,过滤后废渣2为Fe(OH)3,滤液中含有硝酸、硝酸钡等,加入氢氧化钡中和得到硝酸钡溶液,经蒸发、浓缩、过滤可得到硝酸钡晶体,母液中含有硝酸钡,
(1)加入足量的饱和Na2CO3溶液,发生沉淀的转化;
(2)Ba(FeO2)2与HNO3反应生成两种硝酸盐,为硝酸钡、硝酸铁;
(3)除杂时不能引入新杂质,废渣2为调节pH时铁离子转化生成的沉淀;
(4)剩余的滤液中仍含有少量的Ba(NO3)2;
(5)发生Ba(NO3)2+H2SO4=BaSO4↓+2HNO3,称量沉淀质量为m g,为硫酸钡的质量,结合反应计算.
解答 解:钡泥主要含BaCO3、BaSO3、Ba(FeO2)2等,加入硝酸,在a容器中充分溶解,可生成硫酸钡,过滤后滤液中含有铁离子、钡离子等,且溶液呈酸性,可加入碳酸钡,调节溶液pH=4~5,使铁离子水解生成Fe(OH)3沉淀,过滤后废渣2为Fe(OH)3,滤液中含有硝酸、硝酸钡等,加入氢氧化钡中和得到硝酸钡溶液,经蒸发、浓缩、过滤可得到硝酸钡晶体,母液中含有硝酸钡,
(1)溶液存在BaSO4(aq)+CO32-(aq)?BaCO3(aq)+SO42-(aq),增大碳酸根离子的浓度,当c(CO32-)×c(Ba2+)>Ksp(BaCO3)时,可实现沉淀的转化,
使平衡正向移动从而除去BaSO4杂质,
故答案为:BaSO4(aq)+CO32-(aq)?BaCO3(aq)+SO42-(aq);
(2)Ba(FeO2)2与中钡元素为+2价,铁元素为+3价,所以反应产物为Ba(NO3)2和Fe(NO3)3,其反应方程式为Ba(FeO2)2+8HNO3═Ba(NO3)2+2Fe(NO3)3+4H2O,
故答案为:Ba(FeO2)2+8HNO3=Ba(NO3)2+2Fe(NO3)3+4H2O;
(3)X既要能中和硝酸,又不产生新杂质,结合工厂实际,应该用BaCO3来调节pH,由以上分析可知过滤后废渣2为Fe(OH)3,
故答案为:③;Fe(OH)3;
(4)通过蒸发浓缩、冷却结晶、过滤,得到硝酸钡晶体,剩余的滤液中仍含有少量的Ba(NO3)2,所以含有Ba(NO3)2的母液应该,循环到容器c中,
故答案为:c;
(5)称取w克晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量沉淀质量为m克,其发生的反应为Ba(NO3)2+H2SO4=BaSO4↓+2HNO3,
设参加反应的Ba(NO3)2为xg,
Ba(NO3)2+H2SO4=BaSO4↓+2HNO3
261 233
x mg
则$\frac{261}{x}=\frac{233}{mg}$,解得x=$\frac{261m}{233}$g,所以该Ba(NO3)2的纯度为$\frac{\frac{261m}{233}}{w}$×100%=$\frac{261m}{233w}$×100%,
故答案为:$\frac{261m}{233w}$×100%.
点评 本题考查混合物分离提纯,为高频考点,把握流程中的反应、物质的性质、混合物分离方法为解答的关键,侧重分析与实验能力的考查,综合性较强,题目难度中等.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:选择题
| A. | pH=2的HA溶液与pH=12的MOH溶液以任意比混合:c(H+)+c(M+)>c(OH-)+c(A-) | |
| B. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液的物质的量浓度:c(NaOH)<c(CH3COONa)<c(Na2CO3) | |
| C. | 物质的量浓度相等的CH3COOH和CH3COONa两溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH) | |
| D. | 0.1 mol•L-1的NaHA溶液,测得pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数位次递增.B原子的p轨道半充满,形成氢化物的沸点是同主族元素的氢化物中最低的是.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子 化合物.E的原子序数为31,F与B属同一主族,E与F形成的化合物常用于制造半导体. 请根据以上信息,回答下列问题:
已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数位次递增.B原子的p轨道半充满,形成氢化物的沸点是同主族元素的氢化物中最低的是.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子 化合物.E的原子序数为31,F与B属同一主族,E与F形成的化合物常用于制造半导体. 请根据以上信息,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
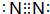 ,Z的原子结构示意图
,Z的原子结构示意图 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径大小为W<X<Y<Z | |
| B. | W与X、Y、Z分别形成最简单化合物中最稳定的是Z | |
| C. | W与Y可形成既含极性共价键又含非极性共价键的化合物 | |
| D. | 由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
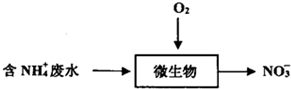
| A. | 生物硝化法处理废水,会导致水体pH逐渐下降:NH4++202=NO3-+2H++H20 | |
| B. | 长期过量使用NH4Cl等铵态化肥,易导致土壤酸化,水体富营养化 | |
| C. | 检验NH4+所需的试剂是浓NaOH溶液,湿润的蓝色石蕊试纸 | |
| D. | 微生物保持活性的pH范围为7〜9,可以加入石灰石来调节水体的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
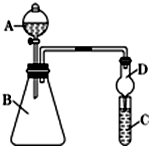 小明和同班同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
小明和同班同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com