

图3-13
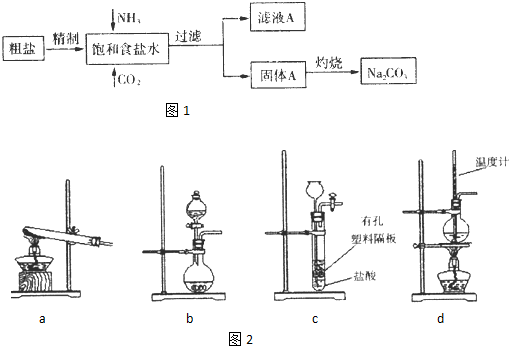
(1)⑥中发生反应的化学方程式为_______________________________________。
(2)①中的实验现象为_________________________,此实验证明SO2是______气体。
(3)②中的品红溶液__________________________,证明SO2有_____________性。
(4)③中的实验现象是_________________________,证明SO2有____________性。
(5)④中的实验现象是_________________________,证明SO2有____________性。
(6)⑤的作用是___________________,反应方程式为____________________________。
解析:Na2SO3是弱酸盐,能与H2SO4发生复分解反应;H2SO3是弱酸,能使石蕊试液变红色;SO2具有漂白作用,可使品红褪色;SO2具有氧化性,能与还原性气体发生反应,生成S沉淀:2H2S+SO2![]() 2H2O+3S↓
2H2O+3S↓
SO2具有还原性,能将氯水还原为无色的HCl:
SO2+Cl2+2H2O![]() H2SO4+2HCl,SO2是酸性气体,可被NaOH吸收,反应生成盐和水。
H2SO4+2HCl,SO2是酸性气体,可被NaOH吸收,反应生成盐和水。
答案:(1)Na2SO3+H2SO4![]() Na2SO4+H2O+SO2↑ (2)变红色 酸性 (3)褪色 漂白
Na2SO4+H2O+SO2↑ (2)变红色 酸性 (3)褪色 漂白
(4)变浑浊 氧化 (5)褪色 还原 (6)吸收剩余SO2,防止SO2污染空气
SO2+2NaOH![]() Na2SO3+H2O(或NaOH+SO2
Na2SO3+H2O(或NaOH+SO2![]() NaHSO3)
NaHSO3)


科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
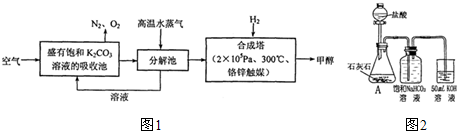
| ||
| ||
| 实验编号 | 1 | 2 | 3 |
| 混合物的质量/g | 3.76 | 4.70 | 8.46 |
| 硫酸溶液的体积/mL | 50.00 | 50.00 | 50.00 |
| 生成二氧化碳的物质的量/mol | 0.03 | 0.0375 | 0.03 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
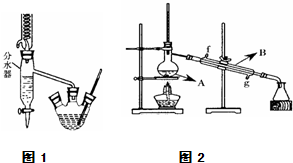 实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表.
实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表.| 化合物 | 相对分子质量 | 密度/g?cm-3 | 沸点/℃ | 溶解度/100g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 CH3COCH2COOC2H5+C2H5OH
CH3COCH2COOC2H5+C2H5OH| 回流 |
| 振荡② |
| 回收有机液体③ |
| 加入乙酸乙酯④ |
| 乙酸酸化⑤ |
| ⑥ |
| ⑦ |
| 钠 | 苯 | 甲苯 | 对二甲苯 | 四氯化碳 | |
| 密度(g/cm3) | 0.97 | 0.88 | 0.87 | 0.86 | 1.60 |
| 熔点(℃) | 97.8 | 5.5 | -95 | 13.3 | -22.8 |
| 沸点(℃) | 881.4 | 80 | 111 | 138.4 | 76.8 |
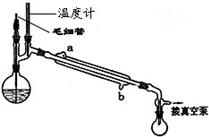
| 无水硫酸钠 |
| 过滤 |
| 水浴蒸馏 |
| 减压蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
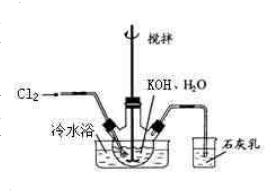 冷水浴冷却,通入Cl2,用电动搅拌器不断搅拌,直至溶液变为黄绿色且有少量白色晶体析出为止.②将饱和次氯酸钾倒入烧杯并置于冷水浴中.在不断搅拌下,分几次加入130gKOH固体.用玻璃砂芯漏斗过滤,弃去残渣(主要成分为KCl和少量KOH、KClO),得次氯酸钾强碱性饱和溶液.
冷水浴冷却,通入Cl2,用电动搅拌器不断搅拌,直至溶液变为黄绿色且有少量白色晶体析出为止.②将饱和次氯酸钾倒入烧杯并置于冷水浴中.在不断搅拌下,分几次加入130gKOH固体.用玻璃砂芯漏斗过滤,弃去残渣(主要成分为KCl和少量KOH、KClO),得次氯酸钾强碱性饱和溶液. 5KCl+KClO3+3H2O,
5KCl+KClO3+3H2O, 5KCl+KClO3+3H2O,
5KCl+KClO3+3H2O,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com