
【题目】常温下, 将稀 HCl溶液滴加到等浓度的弱碱 AOH溶液中, 测得混合液的 pH和lg[C(AOH)/C(A+)] 的关系如图所示, 其中 a点表示未加盐酸时的数据, e点表示 HCl和 AOH恰好完全反应时的数据。下列说法错误的是

A. 常温下, A+的水解平衡常数为 1.0×10-10
B. 点e溶液中水电离出的H+浓度为 10-6.23mol/L
C. 点c 溶液中的 n(A+)+n(AOH)等于点 e溶液中的 n(Cl-)
D. 点d溶液中: c(Cl-)> c(AOH)>c(A+)
【答案】D
【解析】
由图像可知,a点表示未加盐酸时,由图可知,当 lg[c(AOH)/c(A+)]=1时,c(AOH)/c(A+)=10,此时pH=11,根据AOH![]() A++OH-,Kb=
A++OH-,Kb=![]() =
=![]() =10-4;
=10-4;
由题中信息可知,图中e点表示 HCl和 AOH恰好完全反应,溶液为ACl溶液,ACl为强酸弱碱盐水解显酸性,溶液中的H+来自水的电离;c点溶液为中性,c(H+)=c(OH-);d点溶液盐酸过量,溶液为ACl和HCl混合溶液,据此分析解答。
A. 由图可知,a点时lg[C(AOH)/C(A+)]=1,c(AOH)/c(A+)=10,pH=11,Kb=![]() =
=![]() =10-4,则A+的水解平衡常数为
=10-4,则A+的水解平衡常数为![]() =
=![]() =1.0×10-10,故A正确;
=1.0×10-10,故A正确;
B. 由题中信息可知,e点表示 HCl和 AOH恰好完全反应,溶液为ACl溶液,ACl为强酸弱碱盐水解显酸性,溶液中的H+来自水的电离,所以点e溶液中水电离出的 H+浓度为 10-6.23mol/L,故B正确;
C. e点表示 HCl和 AOH恰好完全反应,根据物料守恒:n(A+)+n(AOH)= n(Cl-),
从c点到e点继续滴加盐酸,n(Cl-)增大,但n(A+)+n(AOH)不变,所以点c 溶液中的 n(A+)+n(AOH)等于点 e溶液中的 n(Cl-),故C正确;
D. d点溶液盐酸过量,溶液为ACl和HCl混合溶液,由于A+水解受到抑制,水解程度微弱,所以点d溶液中: c(Cl-) >c(A+)> c(AOH),故D错误。
答案选D。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
【题目】不能用勒夏特列原理解释的是
①打开雪碧的瓶盖,立即有气体逸出
②由H2、I2、HI三种气体组成的平衡体系加压后颜色变深
③可用浓氨水和氢氧化钠固体混合来快速制氨
④煅烧粉碎的硫铁矿有利于SO2生成
⑤使用铁触媒,使N2和H2的混合气体有利于合成NH3
⑥将混合气体中的氨气液化有利于合成氨反应
⑦500℃左右比室温更有利于合成NH3
⑧配制FeCl2溶液时加入少量铁屑
⑨实验室常用排饱和和食盐水法收集Cl2
A. 3项 B. 4项 C. 5项 D. 6项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A是一种重要的化工原料,以A为主要起始原料,通过下列途径可以合成高分子材
料PA及PC。

试回答下列问题
(1)B的化学名称为________,B到C的反应条件是_____________。
(2)E到F的反应类型为__________,高分子材料PA的结构简式为________。
(3)由A生成H的化学方程式为______________________。
(4)实验室检验有机物A,可选择下列试剂中的_____________。
a.盐酸 b.FeCl3溶液 C. NaHCO3溶液 d.浓溴水
(5)E的同分异构中,既能与碳酸氢钠溶液反应、又能发生银镜反应的有机物共有_____种。其中核磁共振氢谐图有5组峰,且峰面积之比为6:1:1:1:1的物质的结构简式为____。
(6)由B通过三步反应制备1.3-环己二烯的合成路线为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以煤、石油综合利用的产品为原料合成最常用的增型剂(邻苯二甲酸二丁酯)的生产流程如图:
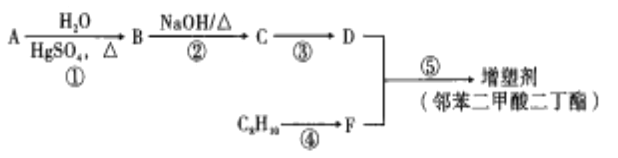
已知:
①烃A是在核磁共振氢谱中只有一组峰的直线型分子;
②R—CHO+CH3CHO![]() R—CHO+H2O;
R—CHO+H2O;
③烷基苯在高锰酸钾酸性溶液的作用下,侧链被氧化成羧基。
回答下列问题:
(1)下列说法正确的是__________(填序号)。
A.煤、石油均为常见的有机物
B.煤中含有苯和甲苯,可以用先干馏后分流的方法把它们分离出来
C.将煤在空气中加强热使之分解的过程,称为煤的干馏,也叫煤的焦化
D.石油催化裂化的过程是为了得到乙烯、丙烯、甲烷等重要化工原料
E.石油在加热和催化剂作用下,可通过结构重新调整,使链状烃转化为环状烃
(2)C8H10的名称为_______________。
(3)反应③和⑤和反应类型分别是__________、__________。
(4)写出反应⑤的化学方程式:______________________________。
(5)在F的同分异构体中,满足下列条件的共有__________种,所有的这些同分异构体中,不同化学环境氢原子的种数____________________(填“相同”和“不相同”)。
a.能与新制的Cu(OH)2悬浊液在加热的条件下反应生成砖红色沉淀
b.能与Na2CO3反应生成CO2
c.能使FeCl3溶液显色
(6)参照上述合成路线,设计一条以乙醇为原料制备1—丁醇的合成路线(无机试剂任用)。合成路线流程示例如下:CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH________________________________________________ 。
CH3CH2OH________________________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. NO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构
B. P4和CH4都是正四面体型分子且键角都为109.5°
C. NH4+的电子式为 ,离子呈平面正方形结构
,离子呈平面正方形结构
D. NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:H2(g)+![]() O2(g)=H2O(g) △H1
O2(g)=H2O(g) △H1
![]() N2(g)+O2(g)=NO2(g) △H2
N2(g)+O2(g)=NO2(g) △H2
![]() N2(g)+
N2(g)+![]() H2(g)=NH3(g) △H3
H2(g)=NH3(g) △H3
则反应2NH3(g)+![]() O2(g)=2NO2(g)+3H2O(g)的△H为
O2(g)=2NO2(g)+3H2O(g)的△H为
A. 2△H1+2△H2-2△H3 B. △H1+△H2-△H3
C. 3△H1+2△H2+2△H3 D. 3△H1+2△H2-2△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25℃,有pH=12的氢氧化钠溶液100mL,要使它的pH降为11.应加蒸馏水的体积为________mL;若加pH=10的氢氧化钠溶液,应加________mL.
(2)某温度下,纯水的c(H+)=3×10﹣7mol/L,Na2S和NaOH两溶液的pH均为12,则两溶液中由水电离出的c(OH﹣)的比值为 ________.
(3)已知 Na2SO4(s)+4H2(g)Na2S(s)+4H2O(g)该温度下,在2L盛有2.84g Na2SO4的密闭容器中通入H2气体,10分钟后测得固体质量为2.264g.则10分钟内H2的平均反应速率为________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质所含原子数由多到少的顺序是( )
①24 g碳 ②0.7 mol NH3 ③4.6 g钠 ④0.2 mol H2SO4 ⑤4 g He
A. ①③②④⑤B. ②①④⑤③
C. ②④①⑤③D. ④⑤②①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氯原子核外有________种不同运动状态的电子;基态溴原子的价电子排布式为_______;比较氟、氯、溴单质熔点的高低并说明理由___________。
(2)HF极易溶于水的原因是______。
(3)已知高碘酸有两种形式,化学式分别为H5IO6( )和HIO4,前者为 五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6______HIO4。(填“>”、“<”或“=”)
)和HIO4,前者为 五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6______HIO4。(填“>”、“<”或“=”)
(4)X射线衍射测定等发现,I3AsF6中存在I3+离子。I3+离子的几何构型为_____,中心原子的杂化类型为_____。
(5)[LiC60]PF6与NaCl具有类似的晶胞结构([LiC60]+表示1个Li+位于1个C60内部)。[LiC60]PF6晶体中包含的化学键有_____________(多选,填字母);
A.金属键B.离子键 C.极性键D.非极性键E.范德华力
已知[LiC60]PF6晶体晶胞边长为a nm,计算[LiC60]PF6晶体的密度为_______g·cm-3(用含a、NA的式子表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com