
【题目】某温度下,气体X和Y在体积为2L的密闭容器中反应,生成气体Z。经测定各物质的物质的量随时间变化如下图所示,经10s达到化学平衡状态,请回答下列问题。
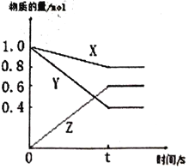
(1)写出该反应的化学反应方程式____________________________________。
(2)0-10s内,Y的平均反应速率为______________________。
(3)达到平衡时,X的转化率为______________________。
【答案】 X+3Y![]() 3Z 0.03mol·L-1·s-1 20%
3Z 0.03mol·L-1·s-1 20%
【解析】根据图像可知X与Y的起始量均是1mol,达到平衡后X是0.8mol,Y是0.4mol,说明X与Y是反应物,Z是生成物,结合图像分析解答。
(1)达到平衡后X减少了1mol-0.8mol=0.2mol,Y减少了1mol-0.4mol=0.6mol,Z增加了0.6mol,因此根据变化量之比是化学计量数之比可知X、Y、Z的化学计量数之比是0.2:0.6:0.6=1:3:3,则该反应的化学反应方程式为X+3Y![]() 3Z;
3Z;
(2)0~10s内Y浓度的变化量是0.6mol÷2L=0.3mol/L,则Y的平均反应速率为0.3mol/L÷10s=0.03mol·L-1·s-1;
(3)达到平衡时,X的转化率为0.2mol/1mol×100%=20%。


科目:高中化学 来源: 题型:
【题目】X,Y,Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X和Y组成原电池时,Y为电池的负极.X,Y,Z三种金属的活动性顺序为( )
A.X>Y>Z
B.X>Z>Y
C.Y>X>Z
D.Y>Z>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,下列叙述是可逆反应N2(g)+3H2(g) ![]() 2NH3(g),在定容密闭容器中达到平衡的标志的是( )
2NH3(g),在定容密闭容器中达到平衡的标志的是( )
①NH3的生成速率与NH3的分解速率相等;
②单位时间内amolN2生成,同时生成3a mol H2 ;
③N2的浓度不再变化;
④混合气体的总压强不再变化;
⑤混合气体的平均摩尔质量不再变化;
⑥用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2;
⑦ N2、H2、NH3的分子数目比为1:3:2;
⑧混合气体的密度不再变化。
A.②⑤
B.①③④⑤
C.②⑥⑦⑧
D.⑤⑥⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是( )
A.Na+、K+、OH-、Cl-B.Mg2+、Na+、SO42-、Cl-
C.Na+、Cu2+、SO42-、NO3-D.Ba2+、HCO3-、NO3-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一个化学过程的示意图。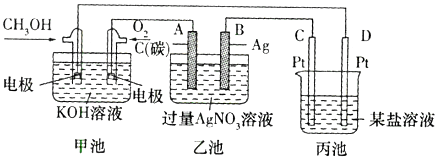
(1)图中丙池是装置(填“电解池”或“原电池”),甲池中K+移向极(填“CH3OH”或“O2”)。
(2)写出通入CH3OH的电极的电极反应式:。
(3)向乙池两电极附近滴加适量紫色石蕊试液,附近变红的电极为极(填“A”或“B")。
(4)乙池中总反应的离子方程式。
(5)当乙池中B(Ag)极的质量增加5.40 g时,乙池的pH是(若此时乙池中溶液的体积为500 mL);通过导线的电量是(结果保留3位有效数字,已知:NA =6.02×1023 , 电子的电量为1.60 ×10-19);此时丙池某电极析出1.60 g某金属,则丙中的某盐溶液可能是
A.MgSO4 B.CuSO4
C.NaCl D.AgNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把a、b、c、d四块金属片浸泡在稀硫酸中,用导线两两相连可以组成各种原电池.若a、b相连时,a为负极;c、d相连时,d上有气泡逸出;a、c相连时,a极减轻;b、d相连时,b为正极.则这四种金属活泼性顺序由强到弱的顺序为( )
A.a>b>c>d
B.a>c>b>d
C.a>c>d>b
D.b>d>a>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组利用右图所示装置制取氨气。请回答下列问题:

(1)实验室制备氨气的化学方程式是____________________________________________________。
(2)请指出装置中的两处错误
①____________________________;②____________________________。
(3)检验试管中收集满氨气的方法是___________________________________________________。
(4)用下列装置吸收多余的氨气,最合理的是_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH。请回答下列问题:
3Zn(OH)2+2Fe(OH)3+4KOH。请回答下列问题:
(1)高铁电池的负极材料是____。
(2)放电时,正极发生____(填“氧化”或“还原”)反应;已知负极反应为Zn-2e-+2OH-====Zn(OH)2,则正极反应为_______________________。
(3)放电时,____(填“正”或“负”)极附近溶液的碱性增强。
II、在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,回答下列问题:
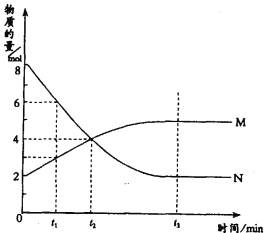
(4)反应的化学方程式为:______________。
(5)反应在_______时刻达到平衡状态。
(6)反应在_____时刻之前正反应速率大于逆反应速率。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com