
【题目】阿伏加德罗常数的值为 NA,下列说法正确的是( )
A. 0.1 mol NaHSO4 晶体中。含有 H+的数目为 0.1NA
B. 28g 乙烯和丙烯(CH2=CHCH3)混合气体中含共价单键的数目为 4NA
C. 1L 0.1 mol/L 的 Na2CO3 溶液中 CO32-和HCO3- 离子数目之和为 0.1NA
D. 质量均为 20g 的 1H218O 与 D2O 中所含中子数均为 10NA
【答案】D
【解析】
A.NaHSO4晶体只含Na+和HSO4-,不含H+,故A错误;B.1mol乙烯含有4mol共价单键,1mol丙烯含有7mol共价单键,设28g混合气中有xmol乙烯,ymol丙烯,则28x+42y=28,即2x+3y=2,则28g 乙烯和丙烯的混合气中含有共价单键总数应为4x+7y=4+y,无法计算,故B错误;C.1L 0.1 mol/L的Na2CO3溶液中,Na2CO3为0.1mol,CO32-存在水解,溶液中含有CO32-,HCO3-和H2CO3,所以CO32-和HCO3-离子数目之和小于0.1mol,即小于0.1NA,故C错误;D.1H218O摩尔质量为20g/mol,D2O的摩尔质量为20g/mol,20g1H218O的物质的量为![]() =1mol,H218O含10个中子,则含有中子数为1mol×10=10mol,20gD2O的物质的量为
=1mol,H218O含10个中子,则含有中子数为1mol×10=10mol,20gD2O的物质的量为![]() =1mol,D2O含有10个中子,则含有中子数为=1mol×10=10mol,即都含有10NA个中子,故D正确;故选D。
=1mol,D2O含有10个中子,则含有中子数为=1mol×10=10mol,即都含有10NA个中子,故D正确;故选D。


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分为Al2O3和SiO2(含有少量不溶性杂质),利用铝土矿制备Al(OH)3流程如下(所用化学试剂均过量)。
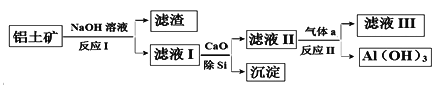
下列说法不正确的是
A. Al(OH)3可用作治疗胃酸过多
B. 加CaO除Si得到的沉淀主要成分为H2SiO3
C. 气体a成分为CO2
D. 滤液III中溶质为Ca(HCO3)2和NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeSO4受热分解的化学方程式为2FeSO4![]() Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑
请回答:
(1)将FeSO4受热产生的气体按图示装置进行实验,证实含有SO3和SO2。能说明SO2存在的实验现象是______________________;为测定BaSO4沉淀的质量,后续的操作步骤依次为________、洗涤、干燥、称量。

(2)设计一个实验方案,用化学方法验证FeSO4受热后固体的成分(不考虑其他反应)
________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图装置也可用于检验溴乙烷与氢氧化钠的醇溶液反应生成物乙烯的检验,下列说法不正确的是
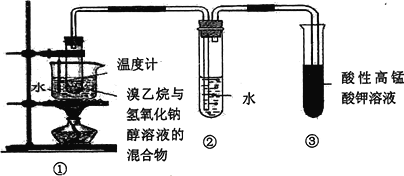
A. 该反应为消去反应 B. 反应实验过程中可观察到酸性KMnO4溶液褪色
C. 可用溴水溶液代替酸性KMnO4溶液 D. 乙烯难溶于水,故此装置②可以省去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸式盐NaHY的水溶液显碱性,下列叙述不正确的是
A.H2Y的电离方程式:H2Y![]() 2H+ + Y2-
2H+ + Y2-
B.HY- 水解的离子方程式:HY- + H2O![]() H2Y + OH-
H2Y + OH-
C.该酸式盐溶液中离子浓度大小关系:c(Na+) > c(HY-)>c(OH-) >c(H+)
D.该酸式盐溶液中微粒浓度关系:c(H+)+c(H2Y) = c(OH-)+c(Y2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下用0.1000mol/L的盐酸分别逐滴加入到20.00mL0.1000mol/L的三种一元碱XOH、MOH、YOH溶液中,溶液的pH随加入盐酸体积的变化如图所示。下列叙述错误的是
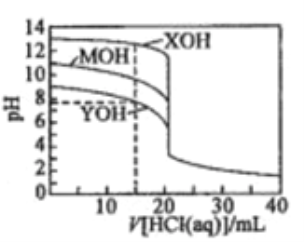
A. XOH为强碱,MOH、YOH均为弱碱
B. V[HCl(aq)]=15.00mL时,三种溶液中离子总浓度大小顺序:XOH>MOH>YOH
C. V[HCl(aq)]=20.00mL时,三种溶液中水的电离程度:XOH>MOH>YOH
D. V[HCl(aq)]=40.00ml.时,YOH溶液中:c(H+)=c(Y+)+c(OH-)+2c(YOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度是2.18g/cm3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验中可以用下图所示装置制备1,2-二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有浓溴水(表面覆盖少量水)。请填写下列空白:
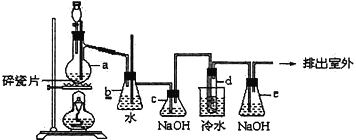
(1)图中碎瓷片的作用是_________________________,若在反应过程中发现未加碎瓷片,应该_____________________________。
(2)烧瓶a中温度计的作用是___________________,该反应是乙醇的脱水反应,即消去反应,反应温度是170℃,并且该反应要求温度迅速高到170℃,否则容易产生副反应。请你写出该副反应的反应方程式:_______________________________。
(3)写出制备1, 2-二溴乙烷的化学方程式:_______________________________。
(4)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象:_______________________________。
(5)容器c中NaOH溶液的作用是:_______________________________。
(6)某学生做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超出许多,如果装置的气密性没有问题,试分析其可能的原因_________________________。
(7)e装置内NaOH溶液的作用是_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:

资料:TiCl4及所含杂质氯化物的性质

(1)Ti是一种活泼金属,原子核内有22个质子,它在周期表中的位置是____________。
(2)根据上表信息推测TiCl4中含有的化学键类型是_______________。
(3)MgCl2的电子式为____________。
(4)氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有_________________。
(5)精制过程:粗TiCl4经两步蒸馏得纯TiCl4如图。

①物质a是__________________(填化学式)。
②T1应控制在______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com