
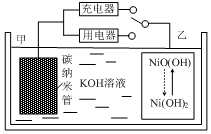
 2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( )
2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( )| A. | 放电时,甲电极为正极,OH-移向乙电极 | |
| B. | 放电时,乙电极反应为:NiO(OH)+H2O+e-=Ni(OH)2+OH- | |
| C. | 充电时,电池的碳电极与直流电源的正极相连 | |
| D. | 电池总反应为H2+2NiOOH$?_{充电}^{放电}$2Ni(OH)2 |
分析 开关连接用电器时,应为原电池原理,甲电极为负极,负极上氢气失电子发生氧化反应,电极反应式为H2+2OH--2e-═2H2O,乙电极为正极得电子发生还原反应,电极反应为:NiO(OH)+H2O+e-═Ni(OH)2+OH-;开关连接充电器时,为电解池,充电与放电过程相反,据此解答.
解答 解:A.放电时,该电池为原电池,电解质溶液中阴离子向负极移动,所以OH-向负极甲电极移动,故A错误;
B.放电时,乙电极为正极得电子发生还原反应,电极反应为:NiO(OH)+H2O+e-═Ni(OH)2+OH-,故B正确;
C.放电时,氢气在碳电极发生氧化反应,碳电极作负极,充电时,碳电极发生还原反应作阴极,应与电源的负极相连,故C错误;
D.放电时,正极电极反应式为2NiO(OH)+2H2O+2e-═2Ni(OH)2+2OH-,负极电极反应式为:H2+2OH--2e-═2H2O,则两式相加得总反应:H2+2NiOOH$?_{充电}^{放电}$2Ni(OH)2,故D正确;
故选BD.
点评 本题考查了原电池和电解池原理,明确正负极上发生的电极反应及阴阳离子的移动方向即可解答,易错选项是C,注意结合电解原理确定与原电池哪个电极相连,为易错点.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:选择题
| A. | 铜全部溶解,且溶液为蓝色,有红棕色气体产生 | |
| B. | 铜部分溶解,且溶液为蓝色,有红棕色气体产生 | |
| C. | 铜全部溶解,且溶液为蓝色,有无色气体产生 | |
| D. | 铜部分溶解,且溶液为蓝色,有无色气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水电离的c( H+)=1×l0-13 mol/L的溶液中:K+、Na+、SiO32-、SO42- | |
| B. | 能溶解Al(OH)3的溶液:NH4+、K+、SO42-、HCO3- | |
| C. | 甲基橙显黄色的溶液:Na+、CO32-、NO3-、SO32- | |
| D. | 1.0 mol/L的CH3COOH溶液:K+、Fe3+、NO3-、Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl是电解质,所以NH4Cl溶液是电解质 | |
| B. | Al2O3是两性氧化物,所以它能溶解于盐酸也能溶于氨水中 | |
| C. | 用FeCl3溶液制作印刷电路板的原因是Fe3+具有氧化性 | |
| D. | Fe(OH)3胶体的本质特征是能产生丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L CCl4中含有的分子数为0.5NA | |
| B. | 在Na2O2与水的反应中,每生成1 mol O2,转移电子的数为2NA | |
| C. | 常温常压下,7.8 g苯中含有双键的数目为0.3NA | |
| D. | 25℃时,0.1 mol•L-1 NH4NO3溶液中含有的铵根离子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Zn(OH)2 | Mn(OH)2 |
| 开始沉淀时的pH | 2.7 | 4.0 | 6.4 | 7.7 |
| 完全沉淀时的pH | 3.7 | 5.2 | 8.0 | 10.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 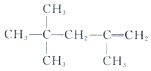 的名称为:2,2,4-三甲基-4-戊烯 的名称为:2,2,4-三甲基-4-戊烯 | |
| B. | 碳原子数小于或等于8的单烯烃,与HBr加成反应的产物只有一种结构,符合条件的单烯烃有6种 | |
| C. | 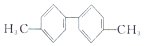 分子中至少有10个碳原子处于同一平面 分子中至少有10个碳原子处于同一平面 | |
| D. | 1 mol β-紫罗兰酮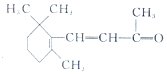 与1 mol H2发生加成反应可得到3种不同产物 与1 mol H2发生加成反应可得到3种不同产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
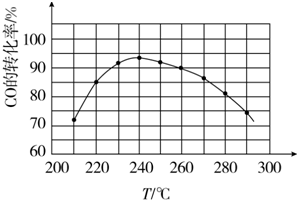
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/mol•L-1 | 0.64 | 0.50 | 0.50 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com