
| A、①中Se是氧化产物,I2是还原产物 |
| B、反应②中浓硫酸体现了氧化性和酸性 |
| C、SeO2、H2SO4(浓)、I2的氧化性由强到弱的顺序是SeO2>H2SO4(浓)>I2 |
| D、反应①中每有0.6molI2生成,转移电子数目为1.2NA |


科目:高中化学 来源: 题型:
| A、糖类是热值最高的营养物质 |
| B、蛋白质溶液遇硫酸铜后产生的沉淀能重新溶于水 |
| C、油脂是油和脂肪的统称,油脂属于酯类 |
| D、在蛋白质溶液中加入饱和硫酸铵溶液,析出的蛋白质再加水也不溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Cl-、HCO3-、SO42- |
| B、Mg2+、Cl-、Al3+、SO42- |
| C、Ca2+、Fe3+、Na+、NO3- |
| D、Ba2+、Cl-、Na+、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、次磷酸的电离方程式为H3PO2?3H++PO23- |
| B、次磷酸中P的化合价为+1 |
| C、NaH2PO2是酸式盐 |
| D、NaH2PO2溶液显弱酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
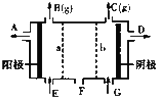 现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽,用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液.下列说法正确的是( )
现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽,用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液.下列说法正确的是( )| A、从A口出来的是H2SO4溶液 |
| B、阳极反应式为2H++2e-═H2↑ |
| C、a是阳离子交换膜,允许H+通过 |
| D、Na2SO4溶液从E口加入 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液是电中性的,胶体是带电的 |
| B、可以用渗析的方法将胶体与溶液分离 |
| C、胶体中的分散质粒子大小在1~10nm之间 |
| D、向煮沸的稀氢氧化钠溶液中滴加饱和和FeC13溶液配制Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示的甲、乙、丙三种晶体,试写出:
如图所示的甲、乙、丙三种晶体,试写出:查看答案和解析>>
科目:高中化学 来源: 题型:
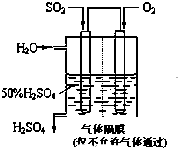 利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.已知:
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.已知:| 1 |
| 2 |
| 10 |
| 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com