
【题目】下图是利用二氧化硅制备硅及其化合物的流程,下列说法正确的是
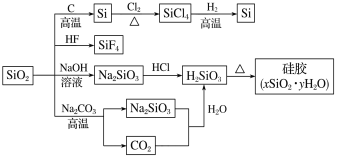
A.SiO2属于两性氧化物B.酸性:H2SiO3>H2CO3
C.硅胶吸水后可重复再生D.图中所示转化反应都是氧化还原反应
科目:高中化学 来源: 题型:
【题目】将20g两种金属的混合物投入足量的稀硫酸中,反应完全后得到标准状况下H2 11.2L,则该混合物的组成可能是( )
A. Na和Fe B. Mg和Cu C. Al和Mg D. Zn和Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硅酸盐及无机非金属材料的说法正确的是
A. 硅酸钠属于盐,不属于碱,所以硅酸钠水溶液可以保存在磨口玻璃塞试剂瓶中
B. 反应①Na2SiO3+H2O+CO2=Na2CO3+H2SiO3↓,反应②Na2CO3+SiO2 ![]() Na2SiO3+CO2↑,两反应是相互矛盾的,不可能都能发生
Na2SiO3+CO2↑,两反应是相互矛盾的,不可能都能发生
C. 普通玻璃、石英玻璃、水泥等均属于硅酸盐材料
D. 祖母绿的主要成分为Be3Al2Si6O18,用氧化物形式表示为3BeO·Al2O3·6SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用Zn与实验室中的盐酸反应制取4.48L H2(标准状况)。
(1)如果选用所贴标签为2.0mol·L-1的盐酸,至少需该盐酸多少毫升?
(2)如果选用所贴标签为7%(密度为1.043g·mL-1)的盐酸,至少需该盐酸多少毫升?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图所示转化关系(X代表卤素),说法不正确的是( )
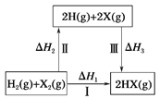
A.![]() △H3<0
△H3<0
B.反应热与反应的途径无关,所以![]()
C.![]() 键、
键、![]() 键、
键、![]() 键键能依次减小,所以途径Ⅱ吸收的热量依次增多
键键能依次减小,所以途径Ⅱ吸收的热量依次增多
D.途径Ⅰ生成HCl放出的热量比生成HBr的多,说明HCl比HBr稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】漂白粉在社会生活、工业生产中用途广泛,漂白粉除了具有漂白作用外,还能杀菌消毒。洪水过后,灾区人们的饮用水必须用漂白粉等药品消毒后才能饮用,以防传染病发生,但瓶装漂白粉久置空气中会呈稀粥状而失效。
(1)漂白粉可用来漂白或杀菌消毒,用化学方程式表示其原理:________________。
(2)用化学方程式表示漂白粉在空气中易失效的原因:________________________。
(3)已知浓盐酸和次氯酸钙能发生如下反应:Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O,用贮存很久的漂白粉与浓盐酸制得的氯气中,可能含有的杂质气体是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
Ⅰ.某同学做如下实验(如图),以检验反应中的能量变化。
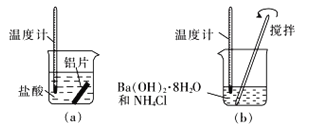
(1)实验中发现反应后(a)中温度升高,由此可以判断(a)中反应是___(填“吸热”或“放热”)反应。
(2)(b)中温度降低,下列各图(如图)所表示的反应是(b)中反应的是_______。
a.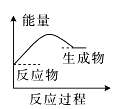 b.
b.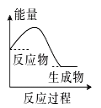 c.
c.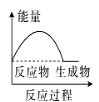 d.
d.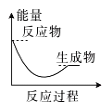
Ⅱ.一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。
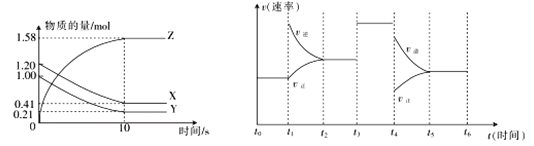
(3)从反应开始到10 s时,用Z表示的反应速率为___________,Y的转化率为________。
(4)若上述反应在10 s后的t1~t6内反应速率与反应时间的图像如图,在每一时刻均改变一个影响反应速率的因素,则t1时改变的因素为__________,t3时改变的因素为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中加入 0.3 mol A、0.1 mol C 和一定量的 B 三种气体, 一定条件下发生如下反应: 3A(g) ![]() B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1 阶段的 c(B)变化未画出]。下列说法中正确的是( )
B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1 阶段的 c(B)变化未画出]。下列说法中正确的是( )
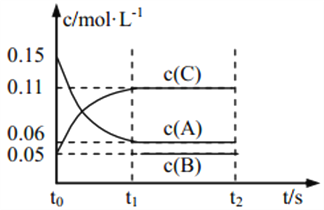
A. 若 t1=15 s,则用 A 的浓度变化表示 t0~t1阶段的平均反应速率为 0.004 mol·L-1·s-1
B. t1时该反应达到平衡, A 的转化率为 60%
C. 该容器的容积为2 L,B的起始的物质的量为 0.02 mol
D. t0~t1 阶段, 此过程中容器与外界的热交换总量为 a kJ,该反应的热化学方程式为 3A(g)![]() B(g)+2C(g) ΔH=-50a kJ·mol-1
B(g)+2C(g) ΔH=-50a kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室要配制1000 mL 2 mol/L NaOH溶液,请回答下列问题:
(1)下面是几种实验中常用的仪器:
A. 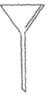 B.
B. ![]() C.
C.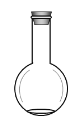 D.
D.![]()
①写出仪器A的名称__________
②配制过程中不需要使用的化学仪器有______(填仪器的字母)。
(2)用托盘天平称取氢氧化钠,其质量为______g。
(3)下列主要操作步骤的正确顺序是_________(填序号)。
①称取一定质量的氢氧化钠,放入烧杯中,用适量蒸馏水溶解;
②加水至液面离容量瓶颈刻度线下1-2厘米时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
③待冷却至室温后,将溶液转移到100 mL 容量瓶中;
④盖好瓶塞,反复上下颠倒,摇匀;
⑤用少量的蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。
(4)下列情况中,会使所配溶液浓度偏高的是___________(填序号)。
A.定容时观察液面俯视 B.没有进行上述的操作步骤⑤
C.称量的氢氧化钠已潮解 D.容量瓶使用前内壁沾有水珠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com