
【题目】下列说法错误的是( )
A. 三硝基甲苯的分子式为C7H3N3O6
B. 等质量的甲烷、乙烯、1,3-丁二烯分别充分燃烧,所耗用氧气的量依次减少
C.  在核磁共振氢谱中能出现两个峰,且其峰面积之比为3∶1
在核磁共振氢谱中能出现两个峰,且其峰面积之比为3∶1
D. 2,3-二甲基丁烷的核磁共振氢谱中会出现两个峰
 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
【题目】水合草酸亚铁(FeC2O4·xH2O)是生产锂电池的原料。难溶于水,受热易分解。某化学兴趣小组对草酸亚铁的一些性质进行探究。回答下列问题:
(1)将水合草酸亚铁溶于适量盐酸。分别取2 mL此溶液于3支试管中,进行实验。能证明水合草酸亚铁中存在Fe2+的试剂有____(填代号)。
A.KSCN溶液 B.K3[Fe(CN)6]溶液 C.酸性KMnO4溶液
(2) 为测定水合草酸亚铁中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为m2 g。按下图连接好装置进行实验。
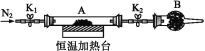
实验步骤如下:
a.打开K1和K2,缓缓通入N2; b.低温加热装置A一段时间;
c.停上加热,冷却到室温; d.关闭K1和K2,称量A;
e. ,记为m3 g。
①补充实验步骤e为__________(填实验操作和要求)。
②步骤b至步骤e继续通入N2的目的是___________________。
(3)为探究草酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示部分的装置(可重复选用)进行实验。打开K1和K2,缓缓通入N2,充分加热。实验后石英玻璃管中固体仅残留一种有磁性的黑色化合物。
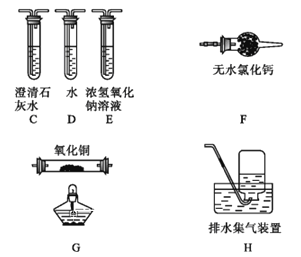
①实验装置中,依次连接的合理顺序为A→_______________。
②证明产物有CO生成的现象是________________。
③写出草酸亚铁受热分解的化学方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学进行有关铜、硝酸、硫酸化学性质的实验,实验过程如图所示:

①、③均观察到实验现象:溶液呈蓝色,试管口有红棕色气体产生。下列说法正确的是
A. ①试管口有红棕色气体产生,原因是硝酸被还原为NO2
B. 由③的现象可得出结论:Cu可与稀硫酸反应
C. ③中反应的离子方程式:3Cu+2NO3-+8H+ === 3Cu2++2NO↑+4H2O
D. ③中可能产生SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
SO2(g)+2CO(g)![]() 2CO2(g)+S(l)△H<0 若反应在恒容的密闭容器中进行,下列有关说法正确的是
2CO2(g)+S(l)△H<0 若反应在恒容的密闭容器中进行,下列有关说法正确的是
A. 平衡前,随着反应的进行,容器内压强始终不变
B. 平衡时,其他条件不变,分离出硫,正反应速率加快
C. 平衡时,其他条件不变,升高温度可提高SO2的转化率
D. 其他条件不变,使用不同催化剂,该反应平衡常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入X并发生反应:2X(g)![]() Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是( )
Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是( )
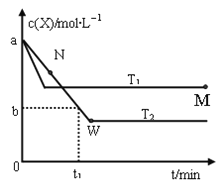
A. 该反应进行到M点放出的热量大于进行到W点放出的热量
B. T2下,在0~t1时间内,υ(Y)=![]() mol/(L·min)
mol/(L·min)
C. M点的正反应速率υ正大于N点的逆反应速率υ逆
D. M点时再加入一定量的X,平衡后X的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各反应中,氧化反应与还原反应在同种元素中进行的是
A.Cl2+2NaOH===NaCl+NaClO+H2O
B.2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
C.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
D.2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水溶液中能大量共存的一组是( )
A.NH4+、Ag+、CO32﹣、SO42﹣B.Fe3+、H+、NO3﹣、Cl﹣
C.Fe3+、NH4+、I﹣、Cl﹣D.H+、Mg2+、NO3﹣、HCO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知亚硫酸钠在空气中能被氧气氧化成硫酸钠。某兴趣小组为检验亚硫酸钠固体是否变质及探究二氧化硫的性质,设计了如下实验:

I.检验Na2SO3是否变质
(1)往圆底烧瓶A中加入待测液1.0 mol/LNa2SO3溶液50mL溶液a为_______,溶液b为_______。
(2)向装置A中滴加足量溶液a,Na2SO3反应完全后,微热装置A使SO2完全逸出。实验前后测得C装置增重2.4g,则Na2SO3溶液物质的量浓度为_______mol/L,并判断Na2SO3固体是否变质______(填是或否)。

II.利用以上装置制备适量SO2,设计实验比较H2SO3、 H2CO3和H2SiO3的酸性强弱,并探究SO2的化学性质。
(1)试剂X是___________;试剂Y是___________;试剂Z是___________。
(2)关闭止水夹b,打开止水夹a,向装置中通入SO2,当观察到_________,即证明H2CO3酸性比H2SiO3强。
(3)关闭止水夹a,打开止水夹b,继续通入SO2,溴水褪色,说明SO2具有_______;写出相应的离子方程式______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com