
【题目】关于有机物![]() (
(![]() )、
)、![]() (
(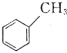 )、
)、![]() (
(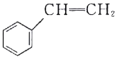 )的说法正确的是( )。
)的说法正确的是( )。
A.![]() 和
和![]() 的一氯代物均有三种结构
的一氯代物均有三种结构
B.![]() 和
和![]() 互为同分异构体,
互为同分异构体,![]() 和
和![]() 互为同系物
互为同系物
C.![]() 、
、![]() 、
、![]() 分子中的所有原子可能在同一平面上
分子中的所有原子可能在同一平面上
D.![]() 、
、![]() 、
、![]() 三种物质均能使酸性KMnO4溶液褪色
三种物质均能使酸性KMnO4溶液褪色
【答案】D
【解析】
A.![]() 有三种不同位置的H原子,因此其一氯代物有三种结构;而
有三种不同位置的H原子,因此其一氯代物有三种结构;而![]() 分子中H原子有四种不同位置,分别是甲基上的H原子及苯环上甲基连接的C原子的邻位、间位、对位上的H原子,因此有四种一氯代物,A错误;
分子中H原子有四种不同位置,分别是甲基上的H原子及苯环上甲基连接的C原子的邻位、间位、对位上的H原子,因此有四种一氯代物,A错误;
B.![]() 和
和![]() 分子式相同,结构不同,二者互为同分异构体;
分子式相同,结构不同,二者互为同分异构体;![]() 分子式是C7H8,而
分子式是C7H8,而![]() 分子式是C8H8,二者结构不相似,分子组成也不是相差CH2的整数倍,因此二者不能互为互为同系物,B错误;
分子式是C8H8,二者结构不相似,分子组成也不是相差CH2的整数倍,因此二者不能互为互为同系物,B错误;
C.![]() 、
、![]() 中都含有饱和C原子,具有甲烷的四面体结构,因此不可能分子中的所有原子在同一平面上,C错误;
中都含有饱和C原子,具有甲烷的四面体结构,因此不可能分子中的所有原子在同一平面上,C错误;
D.![]() 含有不饱和的碳碳双键,能够被酸性KMnO4溶液氧化;
含有不饱和的碳碳双键,能够被酸性KMnO4溶液氧化;![]() 、
、![]() 都含有苯环,且与苯环连接的C原子上有H原子,二者都可以被KMnO4溶液氧化产生苯甲酸,因此三种物质均能使酸性KMnO4溶液褪色,D正确;
都含有苯环,且与苯环连接的C原子上有H原子,二者都可以被KMnO4溶液氧化产生苯甲酸,因此三种物质均能使酸性KMnO4溶液褪色,D正确;
故合理选项是D。


科目:高中化学 来源: 题型:
【题目】用有机物甲可制备环己二烯(![]() ),其反应路线如图所示:
),其反应路线如图所示:

下列有关判断不正确的是
A.甲的分子式为 C6H12
B.乙与环己二烯互为同系物
C.上述流程发生的反应类型有取代反应、消去反应、加成反应
D.环己二烯与溴水 1:1 反应可得 2 种产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示:
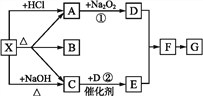
图中每一方格表示有关的一种反应物或生成物,其中A、C为无色气体,请填写下列空白:
(1)物质X可以是______,C是_________, F是______。
(2)反应①的化学方程式是_________,反应②的化学方程式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】塑料、橡胶等材料的交联剂F的合成路线如图所示:
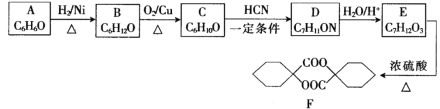
已知: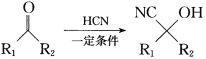
回答下列问题:
(1)芳香族化合物A中官能团的名称为________________。
(2)C→D的反应类型是_______________,E的结构简式为________________。
(3)F与NaOH反应的化学方程式为___________________________________。
(4)F的同分异构体中符合下列条件的有______________(不考虑立体异构)种。
a.属于![]() 的二取代物
的二取代物
b.取代基处于对位且完全相同
c.含酯基且能发生银镜反应
其中核磁共振氢谱有4组峰,峰面积之比为6:2:1:1的结构简式为__________________(写出一种)。
(5)参照题干中合成路线,设计以丙酮为主要原料制备 的合成路线(无机试剂任选)。________________________
的合成路线(无机试剂任选)。________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z、M、N六种主族元素,它们在周期表中位置如图所示,下列说法正确的是( )
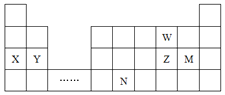
A.原子半径:![]() 简单离子半径:
简单离子半径:![]()
B.单质的还原性:![]() 简单氢化物的沸点:
简单氢化物的沸点:![]()
C.溴与元素M同主族,最高价氧化物的水化物的酸性比M的强
D.元素N位于金属与非金属的分界线附近,可以推断N的单质可作半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中①到⑩10种元素,填写下表空白:

(1)在最高价氧化物对应的水化物中,酸性最强的化合物的化学式是______,碱性最强的化合物的化学式是______。![]() 均填化学式
均填化学式![]()
(2)最高价氧化物对应的水化物是两性的元素是______![]() 填元素符号
填元素符号![]() ,写出它的氢氧化物与⑤的氢氧化物反应的离子方程式______。
,写出它的氢氧化物与⑤的氢氧化物反应的离子方程式______。
(3)③⑤⑥三元素形成的简单离子具有相同的电子层结构,它们的离子半径由大到小顺序是![]() 用离子符号表示
用离子符号表示![]() ______。
______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】经最新研究发现,NOx和SOx是形成雾霾天气的主要原因之一,因此研究NOx、SOx等大气污染物的妥善处理具有重要意义。
(1)为了消除NO造成的污染,通常采用一氧化碳和氢气进行催化还原NO。
已知:①N2(g)+O2(g)=2NO(g) ΔH=akJmol-1;
②2H2(g)+O2(g)=2H2O(l) ΔH=bkJmol-1;
③H2O(g)=H2O(l) ΔH=ckJmol-1。
写出H2与NO反应生成N2和水蒸气的热化学方程式:________________________。
(2)目前应用最广泛的烟气氮氧化物脱除技术是NH3催化还原氮氧化物(SCR)技术。反应原理如图所示:
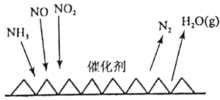
当NO2与NO的物质的量之比为1:1时,与足量氨气在一定条件下发生反应。当有12mol电子发生转移时,则参与反应的NO2的物质的量为________。
(3)T1温度时在容积为2L的恒容密闭容器中发生反应:2NO(g)+O2(g)![]() 2NO2(g) ΔH<0。实验测得:v正=v消耗(NO)=2v消耗(O2)=k正c2(NO)c(O2),v逆=v消耗(NO2)=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO)、n(O2)如表:
2NO2(g) ΔH<0。实验测得:v正=v消耗(NO)=2v消耗(O2)=k正c2(NO)c(O2),v逆=v消耗(NO2)=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO)、n(O2)如表:
时间/ | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 1 | 0.6 | 0.4 | 0.2 | 0.2 | 0.2 |
n(O2)/mol | 0.6 | 0.4 | 0.3 | 0.2 | 0.2 | 0.2 |
①从0~2s该反应的平均速率v(NO2)=________mol/(Ls)。
②T1温度时,上述反应的化学平衡常数K=________。
③若将容器的温度改变为T2时其k正=k逆,则T1________T2(填“![]() ”“
”“![]() ”或“
”或“![]() ”)。
”)。
(4)电解硝酸工业的尾气NO可制备NH4NO3,其工作原理如图。
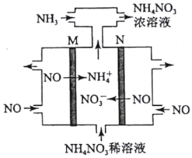
①N极的电极反应式为________________________。
②将电解生成的HNO3全部转化为NH4NO3,则通入的NH3与实际参加反应的NO的物质的量之比至少为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】假设图中原电池产生的电压、电流强度均能满足电解、电镀要求,即为理想化。①~⑧为各装置中的电极编号。下列说法错误的是
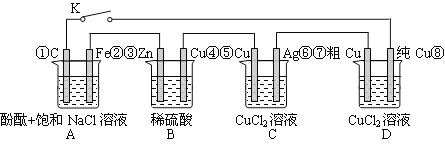
A.当K闭合时,A装置发生吸氧腐蚀,在电路中做电源
B.当K断开时,B装置锌片溶解,有氢气产生
C.当K闭合后,整个电路中电子的流动方向为①→⑧;⑦→⑥;⑤→④;③→②
D.当K闭合后,A、B装置中pH变大,C、D装置中pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烷在燃烧时放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。
已知: 2C3H8(g)+7O2(g)=6CO(g)+8H2O(1) △H1 =-2741.8 kJmol-1
2CO(g)+O2(g)=2CO2(g) △H2=-566.0 kJmol-1
(1)反应C3H8 (g)+5O2(g)=3CO2(g)+4H2O(l) △H=____________;
(2)现有1molC3H8在不足量的氧气里燃烧,生成1molCO和2molCO2以及气态水,将所有的产物通入一个固定体积为1L的密闭容器中,在一定条件下发生如下可逆反应:CO(g)+H2O(g)CO2(g)+H2(g) △H=+41.2kJmol-1
①下列事实能说明该反应达到平衡的是_____________;
a.体系中的压强不再变化 b.v正( H2) = v逆( CO ) c.混合气体的平均相对分子质量不再变化 d.CO2 的浓度不再发生变化
②5min 后体系达到平衡,经测定,容器中含 0.8 mol H2,则平衡常数K =______;
③其他条件不变,向平衡体系中充入少量CO,则平衡常数K______(填“增大”、“减小”或“不变”)
(3)根据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体 ;燃料电池内部是熔融的掺杂着氧化钆(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2-,在电池内部O2-向______极移动(填“正”或“负”);电池的负极电极反应为________。
(4)用上述燃料电池和惰性电极电解足量Mg(NO3)2和NaCl的混合溶液,电解开始后阴极附近的现象为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com