
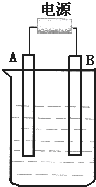
 在如图用石墨作电极的电解池中,放入500mLCuSO4溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量.请回答下列问题:
在如图用石墨作电极的电解池中,放入500mLCuSO4溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量.请回答下列问题:
| ||
| ||
| ||


科目:高中化学 来源: 题型:
| A、K+、Na+、SO42-、CO32- |
| B、Ba2+、Na+、NO3-、Cl- |
| C、Na+、K+、CH3COO-、I- |
| D、Ca2+、K+、Br-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,2.24LH2O含有的分子数等于0.1NA |
| B、20g重水(D2 O)所含的电子数为10NA |
| C、标准状况下,2.24LCl2与过量的稀NaOH 溶液反应,转移电子总数为0.2NA |
| D、25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知Ag2CrO4的Ksp为1.12×10-12,则将等体积的1×10-3mol?L-1的AgNO3溶液和1×10-3mol?L-1K2CrO4溶液混合,会有Ag2CrO4沉淀产生 |
| B、Si-O键的键能大于Si-Cl键的键能,因此SiO2的熔点高于晶体SiCl4的熔点 |
| C、常温时,浓度均为0.01mol/L Na2CO3溶液和NaHCO3溶液,等体积混合,其溶液中粒子浓度关系为3c(Na+)=2c(HCO3-)+2c(CO32-)+2c(H2CO3) |
D、 已知:2CO(g)+O2(g)=2CO2(g);△H=-566kJ?mol-1,如图可表示由CO生成CO2的反应过程和能量关系 已知:2CO(g)+O2(g)=2CO2(g);△H=-566kJ?mol-1,如图可表示由CO生成CO2的反应过程和能量关系 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com