
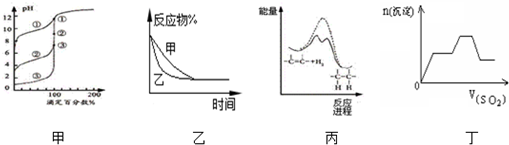
| A. | 用0.1000mol/LNaOH溶液分别滴定浓度相同的三种一元酸,由图甲曲线确定①的酸性最强 | |
| B. | 图乙表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强比甲的压强大 | |
| C. | 由图丙可说明烯烃与H2加成反应是放热反应,虚线表示在有催化剂的条件下进行 | |
| D. | 图丁是足量的SO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入SO2的量的关系图 |
分析 A.滴定开始时,浓度相同的三种一元酸,酸性越强,pH值越小;
B.增大压强平衡正移,反应物的百分含量减小;
C.催化剂降低反应所需活化能,但反应物和生成物能量不变,焓变不变;
D.只要通入SO2,立刻就有沉淀BaSO3产生;将Ba(OH)2消耗完毕,接下来消耗KOH,因而此段不会产生沉淀(即沉淀的量保持不变);KOH被消耗完毕,接下来消耗KAlO2,有Al(OH)3沉淀生成;又因二氧化硫足量,还可以继续与上面反应的产物K2SO3、BaSO3反应.
解答 解:A.由图可知,浓度相同的三种一元酸,滴定前pH值③<②<①,故③的酸性最强,故A错误;
B.可逆反应2A(g)+2B(g)?3C(g)+D(s)是正反应方向为体积减小的方向,所以增大压强平衡正移,反应物的百分含量减小,与图象不符,故C错误;
C.催化剂降低反应所需活化能,但反应物和生成物能量不变,焓变不变,实线表示在有催化剂的条件下进行,故C错误;
D.足量的SO2气体不断通人到含KOH、Ba(OH)2、KAlO2的混合溶液中,SO2先与Ba(OH)2反应生成BaSO3沉淀,所以一开始就会产生沉淀,消耗完Ba(OH)2后,再与KOH溶液反应,生成K2SO3和水,此段不会产生沉淀图象为平台;
KOH消耗完后,SO2再和KAlO2反应生成Al(OH)3,沉淀物质的量增加;
消耗完KAlO2,再与溶液中生成的SO32-反应生成HSO3-,此段不会产生沉淀图象为平台;
然后再与BaSO3反应生成Ba(HSO3)2,部分沉淀溶解,沉淀物质的量减少;
最后通入SO2,沉淀质量不变,为平台,故D正确;
故选D.
点评 本题考查图象分析,侧重考查学生分析判断能力,明确元素化合物性质、化学平衡移动影响因素等知识点是解本题关键,难点是D选项,注意物质反应先后顺序及产物的性质,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 第四周期元素的基态原子中,Cr元素的未成对电子数最多 | |
| B. | 第三周期元素中3p原子轨道有一个未成对电子的原子有2种 | |
| C. | 核外电子数为偶数的基态原子,其原子轨道中可能含有“未成对电子” | |
| D. | 基态碳原子无未成对电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
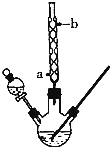 某化学课外小组设计了如图所示的装置制取乙酸乙酯(图中夹持仪器和加热装置已略去).请回答下列问题:
某化学课外小组设计了如图所示的装置制取乙酸乙酯(图中夹持仪器和加热装置已略去).请回答下列问题:| 乙醇 | 乙酸 | 乙酸乙酯 | 98%浓硫酸 | |
| 熔点/℃ | -117.3 | 16.6 | -83.6 | - |
| 沸点/℃ | 78.5 | 117.9 | 77.5 | 338.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、黏合剂及印刷、纺织等工业.乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O,请根据要求回答下列问题:
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、黏合剂及印刷、纺织等工业.乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O,请根据要求回答下列问题:| 同一反应时间 | 同一反应温度 | |||||
| 反应温度/℃ | 转化率(%) | 选择性(%)* | 反应时间/h | 转化率(%) | 选择性(%)* | |
| 40 | 77.8 | 100 | 2 | 80.2 | 100 | |
| 60 | 92.3 | 100 | 3 | 87.8 | 100 | |
| 80 | 92.6 | 100 | 4 | 92.3 | 100 | |
| 120 | 94.5 | 98.7 | 6 | 93.0 | 100 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
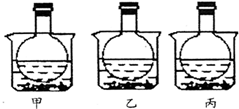 如图所示,三个烧瓶中分别充满等量的NO2气体并分别放置在盛有水的烧杯中,在甲中加入CaO固体,在乙中加入NH4NO3晶体,在丙中加入NaCl固体.下列叙述正确的是( )
如图所示,三个烧瓶中分别充满等量的NO2气体并分别放置在盛有水的烧杯中,在甲中加入CaO固体,在乙中加入NH4NO3晶体,在丙中加入NaCl固体.下列叙述正确的是( )| A. | 甲烧瓶中气体颜色变浅 | B. | 乙烧瓶中气体颜色变深 | ||
| C. | 丙烧瓶中气体压强明显增大 | D. | 上述三种说法都不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
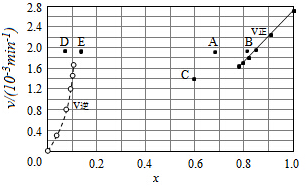 碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠 食盐 NaCl2 | B. | 碳酸氢钠 纯碱 NaHCO3 | ||
| C. | 氢氧化钠 烧碱 NaOH | D. | 氢氧化钙 熟石灰 CaO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
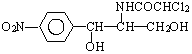 .此药物分子中碳链末端羟基(-OH)中的氢原子换成来自棕榈酸中的原子团
.此药物分子中碳链末端羟基(-OH)中的氢原子换成来自棕榈酸中的原子团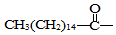 后,苦味消失,成为便于口服的无味氯霉素.以下关于无味氯霉素的叙述中正确的是( )
后,苦味消失,成为便于口服的无味氯霉素.以下关于无味氯霉素的叙述中正确的是( )| A. | 它是棕榈酸的盐类 | B. | 它不是棕榈酸的酯类 | ||
| C. | 它的水溶性变差,所以苦味消失 | D. | 它的水溶性变良,所以苦味消失 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com