
| 高温 |
| ||
| ||
| 3mol |
| 1mol |
| 22.4L |


科目:高中化学 来源: 题型:
| A、向Ca(HCO3)2溶液中加入过量NaOH溶液,有白色沉淀生成:Ca2++HCO3-+OH-═CaCO3↓+H2O |
| B、磷酸一氢钠溶液水解:HPO42-+H2O?PO43-+H3O+ |
| C、将2molSO3气体通入一密闭容器中,达平衡后吸收QkJ热量,则该反应的热化学方程式为:2SO3(g)?2SO2(g)+O2(g)△H=+Q kJ/mol |
| D、向含有0.4 mol FeBr2的溶液中通入0.3 mol Cl2充分反应:4Fe2++2Br-+3Cl2=4Fe3++6Cl-+Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
| A | CO2(g) | SO2(g) | 饱和NaHSO4溶液、浓H2SO4 | 洗气 |
| B | NH4Cl(aq) | Fe3+(aq) | NaOH溶液 | 过滤 |
| C | Cl2(g) | HCl(g) | 饱和NaHCO3溶液、浓H2SO4 | 洗气 |
| D | Na2CO3(s) | NaHCO3(s) | 灼烧 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
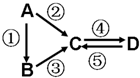 A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如图所示的反应关系:
A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如图所示的反应关系:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分馏、裂化、裂解是利用化学变化来炼制加工石油的三种重要方法 |
| B、蛋白质、淀粉、纤维素都能在人体内水解并提供能量 |
C、使用聚乙烯塑料制品比使用聚乳酸 (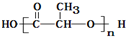 )塑料制品更环保 )塑料制品更环保 |
| D、酶催化反应具有高效、专一、条件温和等特点,化学模拟生物酶对环境保护、节能减排具有重要意义 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有①② |
| B、只有①②④ |
| C、只有①②③ |
| D、上述任意一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N2+3H2?2NH3△H<0;工业上采用20MPa至50MPa的高压条件 | ||||||||
B、
| ||||||||
C、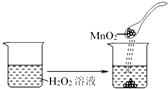 | ||||||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、全部 | B、①②⑤ |
| C、①②④⑤ | D、仅①② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com