
【题目】党的十八大以来,我国在科技创新和重大工程建设方面取得了丰硕成果,在新时代更需要新科技创新世界。2018年3月5日,《自然》连刊两文报道石墨烯超导重大发现,第一作者均为中国科大10级少年班现年仅21岁的曹原。曹原团队在双层石墨烯中发现新的电子态,可以简单实现绝缘体到超导体的转变。石墨烯是一种由碳原子组成六角形呈蜂巢晶格的二维碳纳米材料(如图甲),石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(如图乙)。
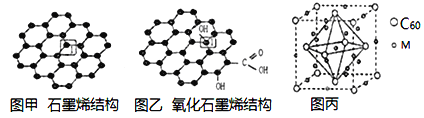
(1)图乙中1号C与相邻C有无形成π键__________(填“有”、或“无”)。
(2)图甲中1号C的杂化方式________。该C与相邻C形成的键角______(填“>”、“<”或“=”)1200。
(3)我国制墨工艺是将50nm左右的石墨烯或氧化石墨烯溶于水,在相同条件下所得到的分散系后者更为稳定,其原因是____________________。
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图丙所示,M原子位于晶胞的棱心与内部。该晶胞中M原子的个数为______________,该材料的化学式为_______________。
(5)金刚石与石墨都是碳的同素异形体。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,金刚石晶胞中碳原子的空间占有率为___________(用含π的代数式表示)。
(6)一定条件下,CH4、CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物晶体俗称“可燃冰”。

①“可燃冰”中分子间存在的2种作用力是_________;
②有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586nm,结合图表从物质结构及性质的角度分析,该设想能否实现:________ (填“能”、或“否”)。
可燃冰与二氧化碳替换的水合物的熔点较高的是_________。
参数 分子 | 分子直径/nm | 分子与H2O的结合能E/(kJ·mol-1) |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | 29.91 |
【答案】无 sp2 = 氧化石墨烯可与水形成氢键更稳定 12 M3C60 ![]() π×100% 氢键、范德华力 能 二氧化碳替换的水合物
π×100% 氢键、范德华力 能 二氧化碳替换的水合物
【解析】
(1)图乙中,1号碳原子形成4个共价单键;
(2)每个C原子要形成4个共价键,根据图知,每个C原子形成2个共价单键、1个共价双键,共价单键为σ键、共价双键中1个是σ键、1个是π键;
(3)氧化石墨烯粒可与水分子形成氢键,稳定性增强;
(4)M原子位于晶胞的棱上与内部,C60分子位于顶点和面心,利用均摊法确定M原子和C60分子的个数比,从而确定化学式;
(5)根据空间占有率=![]() ×100%计算;
×100%计算;
(6)①可燃冰中存在水分子,水分子中存在分子间作用力和氢键;
②依据表格得出二氧化碳的分子直径小于0.586nm,且与水的结合能力为29.91大于16.40。
(1)图乙中,1号碳原子形成4个共价单键,所以其价层电子对个数是4,图乙中1号C与相邻C没有形成π键,故答案为:无;
(2)每个C原子要形成4个共价键,根据图知,每个C原子形成2个共价单键、1个共价双键,共价单键为σ键、共价双键中1个是σ键、1个是π键;图甲中1号C的杂化方式sp2。该C与相邻C形成的键角=1200。故答案为: sp2 ;=;
(3)氧化石墨烯粒可与水分子形成氢键,而石墨烯不能,形成氢键使稳定性增强,
故答案为:氧化石墨烯可与水分子形成分子间氢键而石墨烯不能;
(4)如图M原子位于晶胞的棱上与内部,棱上有12个M,内部有9个M,其个数为12×![]() +9=12,C60分子位于顶点和面心,C60分子的个数为8×
+9=12,C60分子位于顶点和面心,C60分子的个数为8×![]() +6×
+6×![]() =4,M原子和C60分子的个数比为3:1,则该材料的化学式为M3C60,
=4,M原子和C60分子的个数比为3:1,则该材料的化学式为M3C60,
故答案为:12;M3C60
(5)金刚石晶胞如图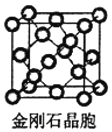 ,该晶胞中C原子个数4+8×
,该晶胞中C原子个数4+8×![]() +6×
+6×![]() =8,金刚石体对角线上的四个原子紧密相连,晶胞棱长a=
=8,金刚石体对角线上的四个原子紧密相连,晶胞棱长a=![]() r,晶胞体积=a3,所有原子体积=
r,晶胞体积=a3,所有原子体积=![]() πr3×8,空间占有率=
πr3×8,空间占有率=![]() ×100%=
×100%=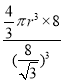 ×100%=
×100%=![]() π×100% ,
π×100% ,
故答案为:![]() π×100% ;
π×100% ;
(6)①CH4与H2O形成的水合物俗称“可燃冰”,分子晶体中作用力是范德华力,水分子之间存在氢键,
故答案为:氢键、范德华力;
②由表格可知:二氧化碳的分子直径小于笼状结构的空腔直径,即0.512<0.586,能顺利进入笼状空腔内,且二氧化碳与水的结合能力强于甲烷,即29.91>16.40,二氧化碳替换的水合物的相对分子质量大,熔较高;
故答案为:能;二氧化碳替换的水合物。


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、N、R均是第三周期主族元素。25℃时,各元素最高价氧化物对应水化物的 pH 与原子半径的关系如图,其中 X、N、W、R 测定的是浓度均为0.01 mol/L溶液的pH,Y、Z测定的是其饱和溶液的pH。下列说法正确的是

A.R、N分别与X形成二元化合物的水溶液均呈碱性
B.N、Z、X三种元素的最高价氧化物均不与水反应
C.单质与 H2化合由易到难的顺序是:R、N、M
D.金属单质与冷水反应由易到难的顺序是:Y、X、Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)△H1
2 H2(g)+ O2(g)= 2H2O(g)△H2
C(s)+ O2(g)=CO2(g)△H3
则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的△H为
A. 12△H3+5△H2-2△H1 B. 2△H1-5△H2-12△H3
C. 12△H3-5△H2-2△H1 D. △H1-5△H2-12△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗是意大利化学家(1776.08.09-1856.07.09),曾开业当律师,24岁后弃法从理,十分勤奋,终成一代化学大师。为了纪念他,人们把1 mol某种微粒集合体所含有的粒子个数,称为阿伏加德罗常数,用N![]() 表示。下列说法或表示中不正确的是
表示。下列说法或表示中不正确的是

A.科学上规定含有阿伏加德罗常数个粒子的任何微粒集合体都为1 mol
B.在K37ClO3+6H35Cl(浓)=KCl+3Cl2↑+3H2O反应中,若有212克氯气生成,则反应中电子转移的数目为5NA
C.60 克的乙酸和葡萄糖混合物充分燃烧消耗2NA个O2
D.6.02×1023mol-1 叫做阿伏加德罗常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各溶液中,一定能大量共存的离子组是
A.常温下水电离的c(H+)为1×10-12mol/L的溶液中:Fe2+、Na+、SO42-、NO3-
B.滴加石蕊后呈蓝色的溶液中:K+、AlO2-、Cl-、HCO3-
C.使石蕊呈红色的溶液:NH4+、NO3﹣、AlO2﹣、I﹣
D.常温下![]() =1014的溶液中:K+、Ba2+、Cl-、Br-
=1014的溶液中:K+、Ba2+、Cl-、Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】奥沙拉秦是曾用于治疗急、慢性溃疡性结肠炎的药物,其由水杨酸为起始物的合成路线如下:
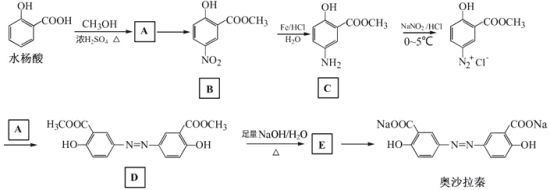
回答下列问题:
(1)A的结构简式为_________;由A制备B的反应试剂和条件为_______________。反应类型为_________。
(2)工业上常采用廉价的CO2与E反应制备奥沙拉秦,通入的CO2与E的物质的量之比至少应为_________。
(3)奥沙拉秦的分子式为_________,其核磁共振氢谱为_______组峰,峰面积比为__________。
(4)若将奥沙拉秦用HCl酸化后,分子中含氧官能团的名称为________________。
(5)W是水杨酸的同分异构体,可以发生银镜反应;W经碱催化水解后再酸化可以得到对苯二酚。W的结构简式为___________。
(6)写出下列反应的化学方程式:
由水杨酸制备A:____________________________________。
由D生成E:________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,将10mol CO和一定量的H2S混合加热并达到下列平衡:CO(g)+H2S(g) ![]() COS(g)+H2(g) K=1,平衡后CO物质的量为8mol。下列说法正确的是( )
COS(g)+H2(g) K=1,平衡后CO物质的量为8mol。下列说法正确的是( )
A.CO、H2S的转化率之比为1∶1
B.达平衡后H2S的体积分数为4%
C.升高温度,COS浓度减小,表明该反应是吸热反应
D.恒温下向平衡体系中再加入CO、H2S、COS、H2各1mol,平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,H2CO3的Ka1=4.2×10-7,Ka2=5.0×10-11。常温下在20mL0.1mol/LNa2CO3溶液中逐滴加入40mL0.1mol/L'HCl溶液,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。

下列说法正确的是
A. 在同一溶液中,H2CO3、HCO3-、CO32-能大量共存
B. a点时:c(Na+)+c(H+)=c(OH-)+3c(CO32-)
C. 当pH=7时,溶液中c(Na+)=c(HCO3-)+2c(CO32-)
D. 当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH=10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
① 用蒸馏水洗涤碱式滴定管后立即注入NaOH溶液至“0”刻度线以上;
② 固定好滴定管并使滴定管尖嘴充满液体;
③ 调节液面至“0”或“0”刻度线稍下,并记下读数;
④ 量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤ 用标准液滴定至终点,记下滴定管液面读数。
请回答:
(1)以上操作步骤中有一步有错误,请指出编号___,该错误操作会导致测定结果___(填“偏大”、“偏小”或“无影响”)。
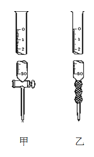
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入___中,该仪器的名称是___。(从图中选填“甲”或“乙”)
(3)下列操作会引起实验结果偏大的是:___(填编号)
A.在锥形瓶装液前,留有少量蒸馏水
B.滴定前,碱式滴定管尖嘴有气泡,滴定后无气泡
C.锥形瓶先用蒸馏水洗涤后,再用待测液润洗
D.用酸式滴定管量取待测液时将一滴待测液滴在锥形瓶外
(4)判断达到滴定终点的现象是:___。
(5)以下是实验数据记录表
滴定次数 | 盐酸体积(mL) | NaOH溶液的读数(mL) | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.00 | 18.28 |
2 | 20.00 | 0.00 | 18.24 |
通过计算可得,该盐酸浓度为:___mol·L-1(计算结果保留2位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com