
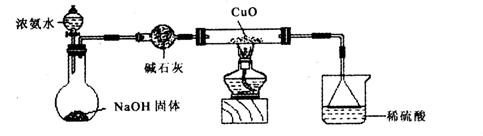
(1)证明氨气具有还原性。已知2NH3+3CuO![]() N2+3Cu+3H2O。
N2+3Cu+3H2O。
①碱石灰的作用是___________,稀硫酸的作用是____________________________________。
②浓氨水与固体NaOH接触,为什么会逸出大量氨气?
③证明NH3具有还原性的实验现象是_______________________________________________。
(2)用吸收了足量尾气的溶掖制取少量硫酸亚铁铵晶体。
已知:硫酸亚铁铵是淡蓝绿色晶体,在空气中性质比较稳定。硫酸亚铁铵在水中的溶解度小于硫酸铵、硫酸亚铁。制备硫酸亚铁铵的化学方程式为:
(NH4)2SO4+FeSO4+6H2O====(NH4)2Fe(SO4)2·6H2O。若溶液的pH>8.1,Fe2+将转化为沉淀。
①吸收了a mol气体后,烧杯中的溶液能使酚酞变红。试依据“化学实验设计基本要求”设计制备硫酸亚铁铵溶液的方案,请简述实验方法。
②为了从溶液中分离出硫酸亚铁铵晶体,还需要进行的实验操作是__________________。
(1) ①吸收水蒸气 吸收氨气
②NaOH吸收溶液中水分放热,使溶液温度升高,氢氧根离子浓度增大,都有利于氨气的逸出
③黑色粉末变为红色,有无色液滴产生
(2) ①加入稀H2SO4调节溶液至酸性(答“调pH 8.1以下”也可);加入约0.5amol硫酸亚铁的浓溶液,搅拌(答“硫酸亚铁”也可) ②加热浓缩;冷却结晶 ;过滤
【解析】(1)由图示信息可知用浓氨水和固体NaOH制氨气,NaOH固体易吸水且放热,导致溶液中OH-浓度增大,所以易使氨气大量逸出。很显然碱石灰干燥氨气,稀硫酸吸收剩余氨气。(2)①酚酞的变色的pH范围为8.2—10,吸收a mol NH3后,烧杯中溶液为红色,可见pH>8.1,必须将溶液调节至酸性,再加入FeSO4溶液才能得到硫酸亚铁铵溶液;②利用加热浓缩,冷却、结晶、过滤的方法可得硫酸亚铁铵晶体。


科目:高中化学 来源:海门市2007学年第一学期高三第一次诊断考试、化学试卷 题型:022
| |||||||||||
查看答案和解析>>
科目:高中化学 来源:江苏省淮安中学2007届高三化学第二次月考试卷 题型:058
| |||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
利用如图所示的装置和其他必要的仪器用品,完成下列实验。

(1)证明氨气具有还原性。已知2NH3+3CuO![]() N2+3Cu+3H2O。
N2+3Cu+3H2O。
①碱石灰的作用是 ,稀硫酸的作用是 。
②浓氨水与固体NaOH接触,为什么会逸出大量氨气?
。
③证明NH3具有还原性的实验现象是 。
(2)用吸收了足量尾气的溶液制取少量硫酸亚铁铵晶体。
已知:硫酸亚铁铵是淡蓝绿色晶体,在空气中性质比较稳定。硫酸亚铁铵在水中的溶解度小于硫酸铵、硫酸亚铁。制备硫酸亚铁铵的化学方程式为:(NH4)2SO4+FeSO4+6H2O==(NH4)2 Fe(SO4)2·6H2O。若溶液的pH>8.1,Fe外将转化为沉淀。
①吸收了![]() mol气体后,烧杯中的溶液能使酚酞变红。试依据“化学实验设计基本要求”设计制备硫酸亚铁铵溶液的方案,清简述实验方法。
mol气体后,烧杯中的溶液能使酚酞变红。试依据“化学实验设计基本要求”设计制备硫酸亚铁铵溶液的方案,清简述实验方法。
。
②为了从溶液中分离出硫酸亚铁铵晶体,还需要进行的实验操作是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
利用如图所示的装置和其他必要的仪器用品,完成下列实验。

已知2NH3+3CuO N2+3Cu+3H2O,该实验证明氨气具有还原性。
(1)碱石灰的作用是 稀硫酸的作用是 。
(2)浓氨水与固体NaOH接触,为什么会逸出大量氨气?
(3)证明NH3具有还原性的实验现象是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com