
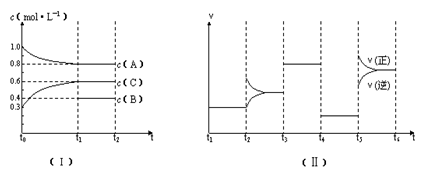
 µÄĒéæö£¬ĖÄøö½×¶ĪøıäµÄĢõ¼ž¾ł²»ĻąĶ¬£¬Ćæøö½×¶ĪÖ»øıäÅØ¶Č”¢Ń¹Ē攢ĪĀ¶Č”¢“߻ƼĮÖŠµÄŅ»øöĢõ¼ž£¬ĘäÖŠt3---t4½×¶ĪĪŖŹ¹ÓĆ“ß»Æ¼Į”£
µÄĒéæö£¬ĖÄøö½×¶ĪøıäµÄĢõ¼ž¾ł²»ĻąĶ¬£¬Ćæøö½×¶ĪÖ»øıäÅØ¶Č”¢Ń¹Ē攢ĪĀ¶Č”¢“߻ƼĮÖŠµÄŅ»øöĢõ¼ž£¬ĘäÖŠt3---t4½×¶ĪĪŖŹ¹ÓĆ“ß»Æ¼Į”£  L”Ŗ1”¤min”Ŗ1”£
L”Ŗ1”¤min”Ŗ1”£

| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 2C(g)“ļµ½Ę½ŗāµÄ±źÖ¾ŹĒ£Ø £©
2C(g)“ļµ½Ę½ŗāµÄ±źÖ¾ŹĒ£Ø £©²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 2Z(g) ¦¤H£¾0£¬T”ꏱ»ÆŃ§Ę½ŗā³£ŹżK = 2£¬ŌŚĆܱÕČŻĘ÷ÖŠ·“Ó¦“ļµ½Ę½ŗā£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
2Z(g) ¦¤H£¾0£¬T”ꏱ»ÆŃ§Ę½ŗā³£ŹżK = 2£¬ŌŚĆܱÕČŻĘ÷ÖŠ·“Ó¦“ļµ½Ę½ŗā£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©| A£®ÉżøßĪĀ¶ČĘ½ŗā³£ŹżK¼õŠ” |
| B£®ČōŃ¹ĖõĢå»ż£¬Ę½ŗāĻņĘųĢåĢå»żŌö“ó·½ĻņŅĘ¶Æ£¬»ģŗĻĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ¼õŠ” |
| C£®±£³ÖĢå»ż²»±ä£¬ĶØČėĻ”ÓŠĘųĢå£¬Ń¹ĒæŌö“ó£¬Ę½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ |
| D£®T”ꏱ£¬Ļņ2LĆܱÕČŻĘ÷ÖŠ¼ÓČė 2molX”¢3molY”¢4molZ£¬·“Ó¦½«Ļņ×ó½ųŠŠ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 mZ(g)””¦¤H£½£a kJmol£1(a>0)£¬ĻÖÓŠ¼×”¢ŅŅĮ½ČŻ»żĻąµČĒŅ¹Ģ¶ØµÄĆܱÕČŻĘ÷£¬ŌŚ±£³ÖøĆĪĀ¶Čŗć¶ØµÄĢõ¼žĻĀ£¬ĻņĆܱÕČŻĘ÷¼×ÖŠĶØČė2 mol XŗĶ1 mol Y£¬“ļµ½Ę½ŗāדĢ¬Ź±£¬·Å³öČČĮæb kJ£»ĻņĆܱÕČŻĘ÷ŅŅÖŠĶØČė1 mol XŗĶ0.5 mol Y£¬“ļµ½Ę½ŗāŹ±£¬·Å³öČČĮæc kJ£¬ĒŅb>2c£¬Ōņa”¢b”¢mµÄÖµ»ņ¹ŲĻµÕżČ·µÄŹĒ
mZ(g)””¦¤H£½£a kJmol£1(a>0)£¬ĻÖÓŠ¼×”¢ŅŅĮ½ČŻ»żĻąµČĒŅ¹Ģ¶ØµÄĆܱÕČŻĘ÷£¬ŌŚ±£³ÖøĆĪĀ¶Čŗć¶ØµÄĢõ¼žĻĀ£¬ĻņĆܱÕČŻĘ÷¼×ÖŠĶØČė2 mol XŗĶ1 mol Y£¬“ļµ½Ę½ŗāדĢ¬Ź±£¬·Å³öČČĮæb kJ£»ĻņĆܱÕČŻĘ÷ŅŅÖŠĶØČė1 mol XŗĶ0.5 mol Y£¬“ļµ½Ę½ŗāŹ±£¬·Å³öČČĮæc kJ£¬ĒŅb>2c£¬Ōņa”¢b”¢mµÄÖµ»ņ¹ŲĻµÕżČ·µÄŹĒ| A£®m£½4 | B£®a£½b | C£®a< | D£®m”Ü2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
A£®·“Ó¦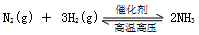 µÄ»ÆŃ§Ę½ŗā³£Źż±ķ“ļŹ½ĪŖ µÄ»ÆŃ§Ę½ŗā³£Źż±ķ“ļŹ½ĪŖ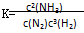 |
| B£®»ÆŃ§Ę½ŗā³£Źż”¢Čõµē½āÖŹµÄµēĄėĘ½ŗā³£Źż”¢ČܶȻż³£Źż¾łÖ»ŹÜĪĀ¶ČµÄÓ°Ļģ |
| C£®¶ŌÓŚČõµē½āÖŹµÄµēĄėĘ½ŗā³£Źż£¬µ±ĪĀ¶ČŅ»¶ØŹ±£¬µēĄėĘ½ŗā³£ŹżŌ½Š”£¬ĘäĖįŠŌŌ½Ēæ |
| D£®½«AgNO3ČÜŅŗŗĶKClČÜŅŗ»ģŗĻŗó£¬Čōc(Ag£«)”¤c(Cl£)£¼KSP(AgCl),ŌņČÜŅŗÖŠĪŽ³ĮµķÉś³É |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 2Z(g)£»”÷H<0£¬ŌŚ²»Ķ¬ĪĀ¶Č£ØT1ŗĶT2£©ĻĀ£¬²śĪļZµÄĪļÖŹµÄĮænÓė·“Ó¦Ź±¼ätµÄ¹ŲĻµČēĶ¼ĖłŹ¾£¬ŌņĻĀĮŠÅŠ¶ĻÖŠÕżČ·µÄŹĒ£Ø £©
2Z(g)£»”÷H<0£¬ŌŚ²»Ķ¬ĪĀ¶Č£ØT1ŗĶT2£©ĻĀ£¬²śĪļZµÄĪļÖŹµÄĮænÓė·“Ó¦Ź±¼ätµÄ¹ŲĻµČēĶ¼ĖłŹ¾£¬ŌņĻĀĮŠÅŠ¶ĻÖŠÕżČ·µÄŹĒ£Ø £©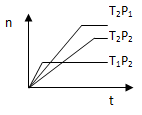
| A£®T1£¼T2£¬P1£¼P2”””””” | B£®T1£¼T2£¬P1£¾P2”””” |
| C£®T1£¾T2£¬P1£¾P2”””””” | D£®T1£¾T2£¬P1£¼P2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 pC(g)ŌŚ²»Ķ¬ĪĀ¶Č(T)”¢Ń¹Ēæ(P)ĻĀ£¬Éś³ÉĪļCµÄÖŹĮæ·ÖŹżC%µÄ±ä»ÆĒéæö”£ĻĀĮŠ¹ŲÓŚøĆÕż·“Ó¦ČČŠ§Ó¦¼°·½³ĢŹ½ÖŠA”¢B”¢CµÄ»Æѧ¼ĘĮæŹżµÄÅŠ¶ĻÖŠ£¬ÕżČ·µÄŹĒ£Ø £©
pC(g)ŌŚ²»Ķ¬ĪĀ¶Č(T)”¢Ń¹Ēæ(P)ĻĀ£¬Éś³ÉĪļCµÄÖŹĮæ·ÖŹżC%µÄ±ä»ÆĒéæö”£ĻĀĮŠ¹ŲÓŚøĆÕż·“Ó¦ČČŠ§Ó¦¼°·½³ĢŹ½ÖŠA”¢B”¢CµÄ»Æѧ¼ĘĮæŹżµÄÅŠ¶ĻÖŠ£¬ÕżČ·µÄŹĒ£Ø £©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
 pC(g) ”÷H=?·“Ó¦Ēéæö¼ĒĀ¼ČēĻĀ±ķ£ŗ
pC(g) ”÷H=?·“Ó¦Ēéæö¼ĒĀ¼ČēĻĀ±ķ£ŗ| Ź±¼ä/(min) | n(A)/( mol) | n(B)/( mol) | n(C)/( mol) |
| 0 | 1 | 3 | 0 |
| µŚ2 min | 0.8 | 2.6 | 0.4 |
| µŚ4 min | 0.4 | 1.8 | 1.2 |
| µŚ6 min | 0.4 | 1.8 | 1.2 |
| µŚ8 min | 0.1 | 2.0 | 1.8 |
| µŚ9 min | 0.05 | 1.9 | 0.3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
 CO2£Øg£©+H2£Øg£©”÷H£¼0””ŹŌ»Ų“šĻĀĮŠĪŹĢā
CO2£Øg£©+H2£Øg£©”÷H£¼0””ŹŌ»Ų“šĻĀĮŠĪŹĢā £ŗ
£ŗ ČōĘšŹ¼Ź±c£ØCO£©="2" mol”¤L-1£¬c£ØH2O£©="3" mol”¤L-1£¬“ļµ½Ę½ŗāŹ±COµÄ×Ŗ»ÆĀŹĪŖ60%£¬ŌņŌŚ“ĖĪĀ¶ČĻĀ£¬øĆ·“Ó¦µÄĘ½ŗā³£ŹżK=
ČōĘšŹ¼Ź±c£ØCO£©="2" mol”¤L-1£¬c£ØH2O£©="3" mol”¤L-1£¬“ļµ½Ę½ŗāŹ±COµÄ×Ŗ»ÆĀŹĪŖ60%£¬ŌņŌŚ“ĖĪĀ¶ČĻĀ£¬øĆ·“Ó¦µÄĘ½ŗā³£ŹżK= ²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com