
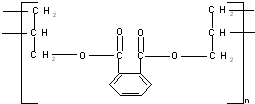
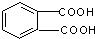
 ⑤邻苯二甲酸甲酯
⑤邻苯二甲酸甲酯 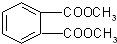
| A. | ①② | B. | ③④ | C. | ②④ | D. | ③⑤ |
科目:高中化学 来源: 题型:解答题
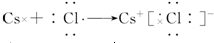 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
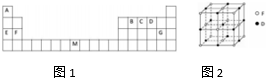
 现有A、B、C、D、E、F原子序数依次增大的六种元素,它们均位于元素周期表有前四周期,A与B位于不同周期且B元素的原子含有3个能级,B元素原子的每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:
现有A、B、C、D、E、F原子序数依次增大的六种元素,它们均位于元素周期表有前四周期,A与B位于不同周期且B元素的原子含有3个能级,B元素原子的每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
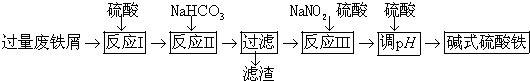
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
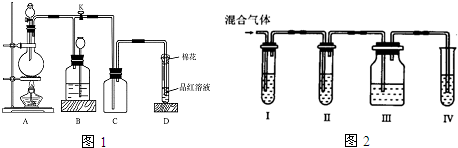
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
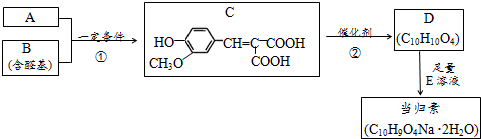
 ;
;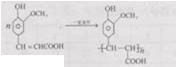 ;
;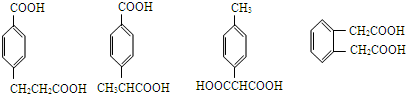 (其中两种).
(其中两种).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | W | Y | Z | Q |
| 原子半径(×10-12m) | 37 | 71 | 74 | 77 | 186 |
| 主要化合价 | +1 | -1 | -2 | +4、-4 | +1 |
| A. | X和Q都属于金属元素 | |
| B. | Y和Z的基态原子s能级和p能级电子数相同 | |
| C. | Y和W的第一电离能大小比较:Y>W | |
| D. | X、Z形成的化合物分子中可能既有σ键又有π键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com