
| A. | 氧化铝可用作耐火材料 | B. | 氧化铁可用作红色油漆和涂料 | ||
| C. | 浓氨水可检验氯气管道漏气 | D. | 二氧化硫可用于食品增白 |
科目:高中化学 来源: 题型:选择题
| A. | 判断黄金首饰中是否掺有铜 | B. | 实验室制取二氧化碳 | ||
| C. | 除去镀在铝表面的铜镀层 | D. | 配制溶解金的王水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3可以用于治疗胃酸过多 | |
| B. | 浓硝酸具有强氧化性,因此浓硝酸可以作为漂白剂 | |
| C. | SiO2可以用于生产太阳能电池 | |
| D. | 在FeCl3饱和溶液里通入足量NH3可制取Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
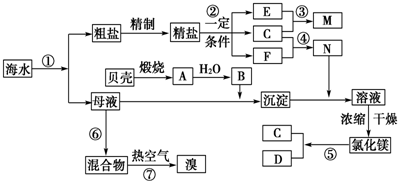 我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务,下图是某化工厂对海水资源综合利用的示意图:
我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务,下图是某化工厂对海水资源综合利用的示意图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫能使织物褪色,对金属材料也有腐蚀作用 | |
| B. | 大量焚烧田间秸秆会污染空气 | |
| C. | 漂白粉在空气中能稳定存在,可用于漂白纸张 | |
| D. | PM2.5是指大气中直径小于或等于2.5微米(2.5×10-6m)的细小可吸入颗粒物,其分散在空气中可能形成胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在水果箱内放入高锰酸钾溶液浸泡过的硅藻土可使水果保鲜 | |
| B. | 侯氏制碱法的工艺过程中应用了Na2CO3溶解度比NaHCO3溶解度小的原理 | |
| C. | 口服硫酸亚铁片时同服维生素C能增强治疗缺铁性贫血效果 | |
| D. | 黑火药由硫磺、硝石(KNO3)、木炭三种物质混合制成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清透明的无色溶液中:Na+、K+、MnO4-、[Al(OH)4]- | |
| B. | 水电离出的[H+]=10-14mol/L溶液中:Fe2+、Mg2+、NO3-、Cl- | |
| C. | 加入铝能产生H2的溶液中:K+、NH4+、I-、NO3- | |
| D. | 常温下c(OH-)=10-13mol/L的溶液中:Mg2+、Cu2+、SO42-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com