
| A. | x+n | B. | x-n | C. | n | D. | n+2 |
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学反应 | 平衡常数 | 温度(℃) | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | ||

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和等体积、等物质的量浓度的盐酸和醋酸溶液,盐酸所需氢氧化钠多于醋酸 | |
| B. | 将氢氧化钠和氨水溶液各稀释一倍,两者的OH-浓度均减少为原来的一半 | |
| C. | 如果盐酸的浓度是醋酸浓度的二倍,则盐酸中氢离子浓度也是醋酸氢离子浓度的二倍 | |
| D. | 物质的量相同的磷酸钠溶液和磷酸溶液中所含的磷酸根离子的量不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 卢瑟福通过α粒子散射实验,证明了电子的存在 | |
| B. | 188O、168O、11H、21H 可以构成六种水分子,他们属于同种物质 | |
| C. | 3717Cl和3517Cl互为同素异形体,最外层电子数都等于7 | |
| D. | 现发现的自然界核素只有100多种,且大多数为金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
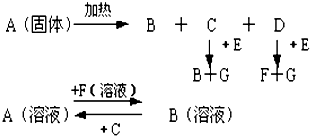
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
物质 T/℃n/mol | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com