
【题目】常温下,某浓度H2A溶液中滴加NaOH溶液,若定义pC=﹣lgC,则测得pC(H2A)、pC(HA-)、pC(A2-)变化如图所示。下列说法正确的是( )
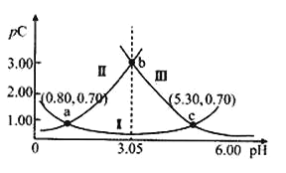
A.曲线II表示pC(HA-)随pH的变化
B.常温下,![]() =104.50
=104.50
C.将等浓度等体积的Na2A与H2A溶液混合后,溶液显碱性
D.a、b、c三点对应的溶液,c(HA-)+c(A2-)+c(HA)始终不变
【答案】B
【解析】
(1)Pc随着pH的变化而变化,说明溶液中存在![]() 和
和![]() ,H2A是一元弱酸;
,H2A是一元弱酸;
(2)pH越大,c(H+)越小,平衡右移程度越大,c(A2-)越大,pc(A2-)越小,所以Ⅲ是pc(A2-),pH越小,c(H+)越大,平衡左移程度越大,c(H2A)越大,pc(H2A)越小,所以Ⅱ是pc(H2A)和pH的关系曲线,Ⅰ是pc(HA-)和pH的关系曲线;
(3)Ka1=![]() ,用a点计算Ka1=c(H+)=10-0.8,Ka2=
,用a点计算Ka1=c(H+)=10-0.8,Ka2=![]() ,用c点计算Ka2=c(H+)=10-5.3。
,用c点计算Ka2=c(H+)=10-5.3。
A.由分析可知,曲线II表示pc(H2A)随pH的变化,A错;
B.Ka1=![]() =,Ka2=
=,Ka2=![]() ,
,![]() =
=![]() =
=![]() =104.50,B正确;
=104.50,B正确;
C.![]() ,用b点计算Kh1=
,用b点计算Kh1=![]() =10-3.05,由分析可知Ka1=10-0.8,所以Ka1>Kh1,所以将等浓度等体积的Na2A与H2A溶液混合后,溶液显酸性,C错误;
=10-3.05,由分析可知Ka1=10-0.8,所以Ka1>Kh1,所以将等浓度等体积的Na2A与H2A溶液混合后,溶液显酸性,C错误;
D.根据物料守恒,a、b、c三点对应的溶液,n(H2A)+n(HA﹣)+n(A2﹣)始终不变,但溶液体积改变,所以浓度之和发生改变,D错误。
答案选B。


 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:
【题目】金属铜是被人们认识和利用较早的金属之一,西汉《淮南万毕术》中有“曾青得铁则化为铜”的记载,“曾青”是CuSO4溶液。回答下列问题:
(1)一些铜盐在灼烧时会产生特殊的颜色,原因是___。
(2)CuSO4溶液中,金属阳离子的最高能层符号为___;其中未成对电子数为___。
(3)CuSO4·5H2O可写成[Cu(H2O)4SO4]H2O,其结构如图所示:

①[Cu(H2O)4]2+中O原子的杂化类型为___。1mol[Cu(H2O)4]2+中含有σ键的个数为___(NA表示阿伏加德罗常数的值)。
②CuSO4·5H2O结构中含有的化学键的类型有___,所含元素的电负性大小顺序为___。
(4)金属铜的晶胞结构如图所示。
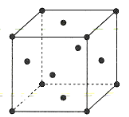
①该晶胞结构中含有由Cu原子构成的正八面体空隙和正四面体空隙,则正八面体空隙数和正四面体空隙数的比为___。
②科研发现硫化铜可以作为一种极为重要的P型半导体,其晶胞结构可以理解为铜晶胞中互不相邻的正四面体形成的空隙被S2-占据,若该晶体的密度为ag·cm-3,则两个最近的S2-之间的距离为___pm(NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上苯乙烯是合成树脂、离子交换树脂及合成橡胶等的重要单体,如图是苯乙烯的结构简式:![]() ,下列关于该有机物的说法不正确的是( )
,下列关于该有机物的说法不正确的是( )
A. 苯乙烯的分子式为C8H8
B. 苯乙烯通过加聚反应可制备高分子化合物
C. 苯乙烯与溴的四氯化碳溶液反应:![]()
D. 苯乙烯能发生加成反应,但不能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三效催化剂是最为常见的汽车尾气催化剂,其催化剂表面物质转化的关系如图所示,下列说法正确的是
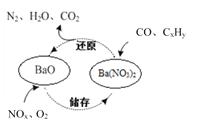
A. 在转化过程中,氮元素均被还原
B. 依据图示判断催化剂不参与储存和还原过程
C. 还原过程中生成0.1mol N2,转移电子数为0.5 mol
D. 三效催化剂能有效实现汽车尾气中CO、CxHy、NOx三种成分的净化
查看答案和解析>>
科目:高中化学 来源: 题型:
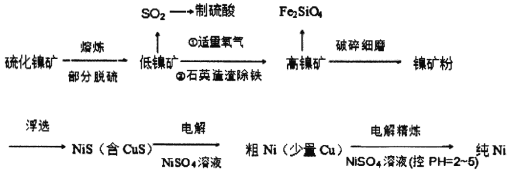
【题目】元素周期表中的28号元素Ni有重要的用途,它有良好的耐高温、耐腐蚀、防锈功能,在电池、催化剂方面也有广泛应用。工业上以硫化镍矿(含少量杂质硫化铜、硫化亚铁)为原料制备并精制镍的基本流程如下:
已知:电极电位(E)能体现微粒的氧化还原能力强弱,如:
H2-2e-=2H+ E=0.00V Cu-2e-=Cu2+ E=0.34V
Fe-2e-=Fe2+ E=-0.44V Ni-2e-=Ni2+ E=-0.25V
(1)镍在周期表中的位置为_______________________________。
(2)高镍矿破碎细磨的作用______________________________________。
(3)焰色反应实验可以用光洁无锈的镍丝代替铂丝蘸取化学试剂灼烧,原因是______________________。
(4)造渣除铁时发生的化学反应方程式___________________________________(产物以氧化形式表示)。
(5)电解制粗镍时阳极发生的主要电极反应式_____________________________________。
(6)工业上由NiSO4溶液制得Ni(OH)2后,再滴加NaC1O溶液,滴加过程中发生反应的离子方程式为_________________________________________________________。
(7)电解精炼镍的过程需控制pH为2~5,试分析原因______________________________,阳极泥的成分为________________(写名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铝陶瓷常用于厚膜集成电路,制备氧化铝陶瓷的合成路线如图所示,回答下列问题。
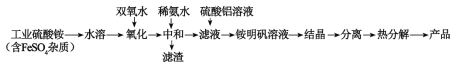
(1)“氧化”步骤发生的离子方程式为:___,使用双氧水作氧化剂优点为___:
(2)“热分解”得到的产物除了氧化铝外,还有NH3、N2、SO2、SO3、H2O生成,则氧化产物和还原产物的物质的量之比为___。
(3)铵明矾晶体的化学式为NH4Al(SO4)2·12H2O,“热分解”步骤中,其各温度段内受热“失重计算值”(失重计算值%=![]() ×100%)如表所示:
×100%)如表所示:
温度区间(℃) | 18→190 | 190→430 | 430→505 | 505→900 |
失重计算值(%) | 39.20 | 7.80 | 13.00 | 26.00 |
通过上述数据经粗略计算可判断,在温度区间___铵明矾基本上失去了全部结晶水。
(4)“结晶”步骤中常采用的操作是___。
(5)合成过程中常使用过量的工业硫酸铵,可利用硫酸铵溶液水解显酸性抑制硫酸铝水解,另外的一个重要作用是___。
(6)通常认为金属离子浓度等于1×10-5mol/L即可认为沉淀完全,试计算常温下“中和”步骤中需要调节溶液pH=___(保留一位小数,已知:Ksp[Fe(OH)3]=8.0×10-38,lg5=0.7)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在日常生活和生产过程中化学有着重要的应用,下列有关说法正确的是![]()
A.洪涝、地震灾区灾后常用石灰对环境进行消毒,是利用石灰可使蛋白质变性的性质
B.食品添加剂对人体均有益,因此在添加时无需对其用量进行严格控制
C.生活中常见的石英玻璃、普通玻璃、钢化玻璃都属于硅酸盐产品
D.根据分散系的稳定性,将分散系分为溶液、胶体和浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白铜是一种铜镍合金,为我国首先发明使用并传入世界各地,其发明在世界化学史和冶金史中都占有重要地位。白铜广泛用于造船、石油、化工、建筑、电力、精密仪表、医疗器械、乐器制作等部门作耐蚀的结构件。
(1)镍元素基态原子的电子排布式为______________,3d能级上的未成对电子数为______。
(2)单质铜、镍都是通过__________ 键形成晶体;比较元素铜与镍的第二电离能大小,I2(Cu)_____I2(Ni) (填“>”或“<”),原因是______________________。
(3)金属镍粉在CO气流中轻微加热,生成无色(或黄色)易挥发的液体Ni(CO)4。 写出一种与Ni(CO)4的配体互为等电子体的物质的分子式_____ ;推测Ni(CO)4的晶体类型是_______。呈正四面体构型的Ni( CO)4。易溶于下列物质中的______(填字母)。
A.水 B.四氯化碳 C.苯 D.硫酸镍溶液
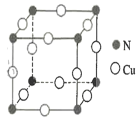
(4)N和Cu元素形成的化合物的晶胞结构如图所示,则该化合物的化学式为______该化合物的摩尔质量为M g●mol-1, NA代表阿伏加德罗常数的值。若该晶胞的边长为a pm,则该晶体的密度是_____g .cm-3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com