
| A. | 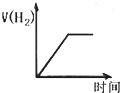 | B. |  | ||
| C. | 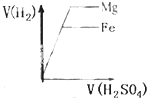 | D. | 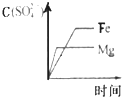 |
分析 Mg的活泼性大于Fe,所以镁、铁合金和稀硫酸混合,镁先和稀硫酸反应、后Fe和稀硫酸反应;
Mg的活泼性大于Fe,所以Mg的反应速率大于Fe;且Mg的摩尔质量小于Fe,相同的物质的量Mg和Fe分别与足量稀硫酸反应,Mg生成氢气的量大于Fe,据此分析解答.
解答 解:A.Mg的活泼性大于Fe,所以镁、铁合金和稀硫酸混合,镁先和稀硫酸反应、后Fe和稀硫酸反应,Mg和Fe的物质的量、摩尔质量不同,导致生成氢气和消耗硫酸的斜率不同,故A错误;
B.Mg先反应、Fe后反应,所以随着反应的进行,固体平均摩尔质量先增大,当镁完全反应后,固体平均摩尔质量不变,直至铁完全反应,故B错误;
C.Mg的活泼性大于Fe,所以Mg的反应速率大于Fe;且Mg的摩尔质量小于Fe,相同的物质的量Mg和Fe分别与足量稀硫酸反应,Mg生成氢气的量大于Fe,故C正确;
D.硫酸根离子不参加反应,无论反应是否进行,溶液中硫酸根离子浓度不变,故D错误;
故选C.
点评 本题以镁、铁为载体考查图象分析,明确图象中每个拐点含义及物质的性质是解本题关键,同时还考查离子反应,易错选项是B.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
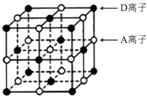 A、B、C、D为短周期主族元素,原子序数依次增大.A和D可形成化合物E,E的焰色反应呈黄色;B是地壳中含量最高的金属元素;C基态原子最外层原子轨道中有两个未成对电子且无空轨道.请回答下列问题:
A、B、C、D为短周期主族元素,原子序数依次增大.A和D可形成化合物E,E的焰色反应呈黄色;B是地壳中含量最高的金属元素;C基态原子最外层原子轨道中有两个未成对电子且无空轨道.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其他条件不变,增大压强,平衡不发生移动 | |
| B. | 其他条件不变,增大压强,混合气体的总质量不变 | |
| C. | 该反应式中n值一定为2 | |
| D. | 原混合气体中A与B的物质的量之比为2:1,且2M(A)+M(B)=3M(D)(其中M表示物质的摩尔质量) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池工作时,锌失去电子 | |
| B. | 电池正极的电极反应式为2MnO2+H2O+2e-═Mn2O3+2OH- | |
| C. | 外电路中每通过0.2mol电子,锌的质量理论上减少13g | |
| D. | 电池工作时,电子由负极通过外电路流向正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )主要存在于烟叶中,有浓郁的玉簪花香气,用于合成香料.现有如下转化关系,其中C能使溴的四氯化碳溶液褪色,E继续被氧化生成F,F的相对分子质量为90.
)主要存在于烟叶中,有浓郁的玉簪花香气,用于合成香料.现有如下转化关系,其中C能使溴的四氯化碳溶液褪色,E继续被氧化生成F,F的相对分子质量为90. $\stackrel{HCN}{→}$A$→_{H_{2}O}^{HCl}$B$→_{△}^{浓H_{2}SO_{4}}$C$→_{②Zn/H_{2}O}^{①O_{3}}$D+E
$\stackrel{HCN}{→}$A$→_{H_{2}O}^{HCl}$B$→_{△}^{浓H_{2}SO_{4}}$C$→_{②Zn/H_{2}O}^{①O_{3}}$D+E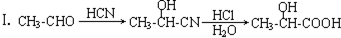
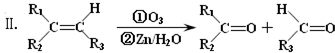
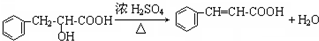 ;该反应类型属消去反应.
;该反应类型属消去反应.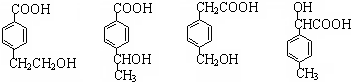 任意一种.
任意一种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
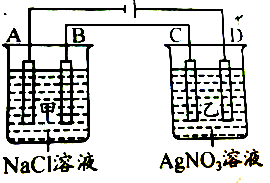 甲、乙两个容器中,分别加入0.1 mol•L -1的 NaCl溶液与0.1 mol•L-1的AgNO3溶液后,以 Pt为电极进行电解时,在A、B、C、D各电极上生成物的物质的量之比为 ( )
甲、乙两个容器中,分别加入0.1 mol•L -1的 NaCl溶液与0.1 mol•L-1的AgNO3溶液后,以 Pt为电极进行电解时,在A、B、C、D各电极上生成物的物质的量之比为 ( )| A. | 2:2:4:1 | B. | 2:3:4:1 | C. | 1:4:2:2 | D. | 1:1:1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com