

| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
分析 (1)根据化合价代数和为0判断铁的化合价;
(2)铁矿石加入过量硫酸溶解,二氧化硅不溶于酸,所以过滤得到滤渣为二氧化硅;
(3)TiO2+在加热条件下水解可以转化成TiO2;
(4)滤液丙与双氧水反应,将亚铁离子氧化成铁离子,得沉淀磷酸铁,磷酸铁再被草酸还原成亚铁离子,根据电子得失守恒可计算双氧水与H2C2O4的质量比;
(5)根据电子守恒和元素守恒,有关系式TiO2~NH4Fe(SO4)2,根据NH4Fe(SO4)2的体积和浓度可计算得TiO2的物质的量,根据$\frac{TiO2质量}{样品质量}$×100%计算TiO2质量分数;
(6)用镁还原TiCl4得Ti,根据元素守恒写化学方程式,高温下Mg(Ti)会与空气中的O2(或CO2、N2)作用,所以不能与空气接触,采用真空蒸馏时,要使其它成份变成蒸气,而Ti不能汽化,结合题中给出的各物质沸点判断温度.
解答 解:(1)根据化合价代数和为0规则可知,化合物FeTiO3中铁元素的化合价是+2价,故答案为:+2;
(2)铁矿石加入过量硫酸溶解,二氧化硅不溶于酸,所以过滤得到滤渣为二氧化硅,故答案为:SiO2;
(3)TiO2+在加热条件下水解可以转化成TiO2,反应离子的方程式为TiO2-+H2O $\frac{\underline{\;\;△\;\;}}{\;}$TiO2↓+2H+,故答案为:TiO2-+H2O $\frac{\underline{\;\;△\;\;}}{\;}$TiO2↓+2H+;
(4)滤液丙与双氧水反应,将亚铁离子氧化成铁离子,得沉淀磷酸铁,磷酸铁再被草酸还原成亚铁离子,根据电子得失守恒有关系式H2C2O4~2FePO4~H2O2,所以17%双氧水与H2C2O4的质量比为$\frac{34}{17%}$:90=20:9,
故答案为:20:9;
(5)根据电子守恒和元素守恒,有关系式TiO2~NH4Fe(SO4)2,所以TiO2的物质的量为cV×10-3mol,所以TiO2质量分数为$\frac{cV×10{\;}^{-3}×M}{w}$×100%,
故答案为:$\frac{cV×10{\;}^{-3}×M}{w}$×100%;
(6)用镁还原TiCl4得Ti,反应的化学方程式为TiCl4+2Mg$\frac{\underline{\;800℃\;}}{\;}$2MgCl2+Ti,高温下Mg(Ti)会与空气中的O2(或CO2、N2)作用,所以反应需要在Ar气中进行,采用真空蒸馏时,要使其它成份变成蒸气,而Ti不能汽化,结合题中给出的各物质沸点可知,需加热的温度略高于1412℃即可,
故答案为:TiCl4+2Mg$\frac{\underline{\;800℃\;}}{\;}$2MgCl2+Ti;高温下Mg(Ti)会与空气中的O2(或CO2、N2)作用;1412.
点评 本题借助利用钛铁矿制备锂离子电池电极材料流程,考查了化合价判断、离子方程式书写、电极方程式书写、化学计算等知识,涉及的内容较多,综合性较强,充分考查了学生的综合能力,本题难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 3:1 | B. | 3:2 | C. | 2:1 | D. | 2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
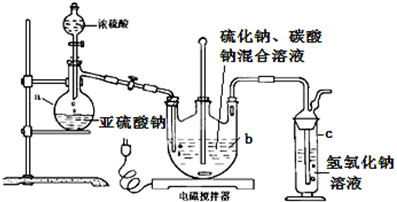
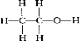 .
.| 实验序号 | 1 | 2 | 3 |
| Na2S2O3溶液体积(mL) | 19.98 | 20.02 | 21.18 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氯化亚锡有广泛的用途,工业可用作催化剂、脱氧剂等.如下是某实验室常用的一种制取无水氯化亚锡的步骤:
氯化亚锡有广泛的用途,工业可用作催化剂、脱氧剂等.如下是某实验室常用的一种制取无水氯化亚锡的步骤:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 品名 | ***蔬菜苏打饼*** |
| 配料 | 面粉、鲜鸡蛋、精炼食用植物油、白砂糖、奶油、食盐、 脱水青菜、橙汁 |
| 保质期 | 十二个月 |
| 生产日期 | 2008 年1月20日 |
| A. | 富含蛋白质的是鲜鸡蛋 | B. | 富含淀粉的是面粉和白砂糖 | ||
| C. | 富含油脂的是精炼食用植物油 | D. | 富含维生素的是脱水青菜和橙汁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com