
【题目】下列离子方程式,书写正确的是
A.澄清石灰水与稀盐酸反应: Ca(OH)2+2H+=Ca2++2H2O
B.稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑
C.硝酸银溶液中加入铜粉:2Ag++Cu=Cu2++2Ag↓
D.盐酸跟氢氧化镁反应:H++OH-=H2O
科目:高中化学 来源: 题型:
【题目】元素①~⑩在周期表中的位置如表所示,试回答下列问题。
周期 族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)上述10种元素中,化学性质最不活泼的是_______(填元素符号,下同) ;与水反应最激烈的金属元素是_______。
(2)元素②的气态氢化物的分子式是_______;上述10种元素中,其最高价氧化物对应水化物的酸性最强的物质是_____(填化学式)。
(3)用电子式表示元素③与④形成1:2型化合物的形成过程_______。
(4)①②⑤元素的原子半径由小到大的顺序为_______(用元素符号表示) ③⑦⑩元素的气态氢化物的稳定性由强到弱的顺序为_______(用氢化物的化学式表示)。
(5)④和⑥两元素的最高价氧化物对应的水化物相互反应的离子方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:软锰矿与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl;用水溶解,滤去残渣,滤液酸化后,K2MnO4转变为MnO2和KMnO4;滤去MnO2沉淀,浓缩滤液,结晶得到深紫色的针状KMnO4。请回答:
(1)软锰矿制备K2MnO4的化学方程式是_______________________;
(2)K2MnO4制备KMnO4的离子方程式是_______________;
(3)若用2.5g软锰矿(含MnO2 80%)进行上述实验,KMnO4的理论产量为_______________。
(4)KMnO4能与热的经硫酸酸化的Na2C2O4溶液反应生成Mn2+和CO2,该反应的化学方程式是________________________;
(5)上述制得KMnO4产品0.165g,恰好与0.335g Na2C2O4反应完全,该KMnO4的纯度为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现:一节电池烂在地里,能够使一平方米的土地失去利用价值。废旧电池的危害上要集中在其中所含的少量重金属上。将废旧锌锰电池回收处理,既能减少它对环境的污染,又能实现废电池的资源化利用。
(1)回收填料中的二氧化锰和氯化铵。已知:废旧干电池填料的主要成分为二氧化锰、炭粉、氯化铵和氯化锌等,其中氯化铵、氯化锌可溶于水。回收物质的流程如图所示。

① 操作中先将电池填料研碎的目的是:________________。
② 操作l和操作2的名称都是___________,该操作中玻璃棒的作用是___________。
③ 灼烧滤渣l的目的是______________________。
(2)回收二氯化锰:将废旧锌锰电池处理,得到含锰混合物,向该混合物加入浓盐酸并加热。
①写出MnOOH与浓盐酸反应的化学方程式:________________。
② 锰回收新方法:向废旧锌锰电池内的混合物[主要成分MnOOH、Zn(OH)2]中加入一定量的稀硫酸和稀草酸(H2C2O4),并不断搅拌至无CO2产生为止,写出MnOOH参与反应的化学方程式______________。与使用浓盐酸回收锰相比,新方法的优点是___________(答l点即可)。
(3)用废电池的锌皮可用于回收制作ZnSO4·7H2O。过程中,需除去锌皮中的少量杂质铁,其方法是:常温下,加入稀H2SO4和H2O2,铁溶解变为Fe3+,加碱调节pH为4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中c(Fe3+)=_________。继续加碱调节pH为____时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。部分难溶的电解质溶度积常数(Ksp)如下表:

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。在一定温度下,用0.1mol/LKOH溶液分别滴定体积均为20mL、浓度均为0.1mol/L的盐酸和醋酸溶液,滴定曲线如图所示。下列有关判断正确的是
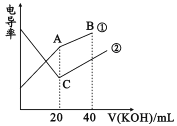
A. B点的溶液中有:c(K+)>c(OH-)>c(CH3COO-)>c(H+)
B. A点的溶液中有:c(CH3COO-)+c(OH-)-c(H+)=0.1mol/L
C. C点水电离的c(OH-)大于A点水电离的c(OH-)
D. A、B、C三点溶液均有Kw=c(H+)·c(OH-)=1.0×10-14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的电镀污泥中含有铜、铁等金属化合物。为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:
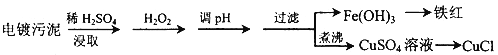
沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 2.3 | 7.6 | 4.4 |
完全沉淀的pH | 3.2 | 9.7 | 6.4 |
(1)酸浸后加入H2O2的目的是____________.调pH的最适宜范围为_______________
(2) 调PH过程中加入的试剂最好是_________
A.NaOH B.CuO C.NH3 ﹒H2O D.Cu2(OH)2CO3
(3)煮沸CuSO4溶液的原因是_____________________。向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,写出该反应的化学方程式________________。
(4)过滤后的沉淀表面通常附着有一些杂质离子,为得到纯净产物,需要进行洗涤,确定沉淀洗涤干净的操作及现象是_________________。
(5) 称取所制备的CuCl样品0.250 0 g置于一定量的0.5 mol﹒L-1FeCl3溶液中,待样品完全溶解后,加水20 mL,用0.1000 mol﹒L-1的Ce((SO4)2溶液滴定,到达终点时消耗Ce((SO4)2溶液25.00 mL。有关的化学反应为 Fe3++CuCl=Fe2++Cu2++Cl-, Ce4++Fe2+=Fe3++Ce3+。计算该CuCl样品的质量分数_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各组离子中,能大量共存的( )
A. Ag+、NO3﹣、Na+、Cl﹣ B. K+、HCO3﹣、Cl﹣、Al3+
C. NO3﹣、Fe2+、H+、Br﹣ D. K+、Cl﹣、SO42﹣、NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时纯水的电离度为a1,pH=2的醋酸溶液的电离度为a2,pH=12的氢氧化钠溶液中水的电离度为a3。若将上述醋酸与氢氧化钠溶液等体积混合,所得溶液中水的电离度为a1。下列关系式中正确的是
A.a2=a3<a4<a1 B.a3 = a2<a1<a4
C.a2<a3<a1<a4 D.a1<a2<a3<a4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2017届广东省清远市清城区高三上期末】在HNO2溶液中存在如下平衡:HNO2H++NO2﹣,向该溶液中加入少量的下列物质后,能使电离平衡向右移动的是( )
A.NaOH溶液 B.硫酸溶液 C.NaNO2溶液 D.NaHSO4溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com