
| A. | 0.03mol/L | B. | 0.16mol/L | C. | 0.08mol/L | D. | 0.04mol/L |
分析 向氯化铝溶液中逐滴加入氢氧化钡溶液时发生的离子反应方程式为:Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+H2O,根据物质之间的关系式计算.
解答 解:n(AlCl3)=0.2mol/L×0.01L=0.002mol,
设氢氧化钡的物质的量浓度为x,
2AlCl3+3Ba(OH)2=2Al(OH)3↓+3BaCl2
2 3 2
0.015x 0.01x
根据铝原子守恒知,当完全转化为氢氧化铝沉淀时,n([Al(OH)3]=n(AlCl3)=0.002mol,
根据2AlCl3+3Ba(OH)2=2Al(OH)3↓+3BaCl2知,完全沉淀时需要n[Ba(OH)2]=$\frac{0.002mol}{2}$=0.003mol,
根据题意知,与氢氧化铝反应的氢氧化钡的物质的量=(0.045x-0.003)mol,
根据2Al(OH)3+Ba(OH)2=Ba(AlO2)2+4H2O可知,生成偏铝酸钡需要n[Al(OH)3]=2n[Ba(OH)2]=2(0.045x-0.003)mol,
根据铝原子守恒得剩余n[Al(OH)3]=0.002mol-2(0.045x-0.003)mol,
测得滴加15mL与滴加45mL所得沉淀同样多,所以0.01xmol=0.002mol-2(0.045x-0.003)mol,解得x=0.08mol/L,
故c(Ba(OH)2)=0.08mol/L,
故选C.
点评 本题考查了物质的量的计算,明确物质间的反应是解本题关键,结合原子守恒分析解答,难度中等.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
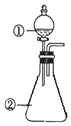 用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )| 选项 | ①中物质 | ②中物质 | 预测②中的现象 |
| A | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
| B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
| C | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
| D | 亚硫酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
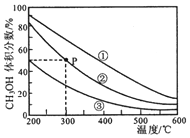
| A. | 该反应的正反应为放热反应 | |
| B. | 三个容器容积:①>②>③ | |
| C. | 在P点,CO转化率为75% | |
| D. | 在P点,向容器②中再充入CO、H2 及 CH3OH 各 0.025mol,此时 v(CO)正<v (CO)逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 | |
| B. | 在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素 | |
| C. | 在地球上元素的分布和它们在元素周期表中的位置有密切关系 | |
| D. | 在金属元素区域可以寻找制备新型农药材料的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| n(CO)/mol | 1.0 | 0.70 | 0.45 | 0.25 | 0.10 | 0.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
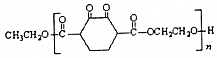 )是人造棉的主要成分之一,合成线路如图:
)是人造棉的主要成分之一,合成线路如图: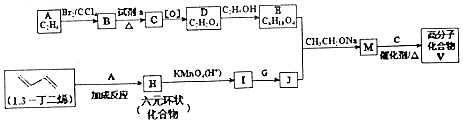
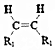 $\stackrel{KMnO_{4}/H+}{→}$2R1COOH
$\stackrel{KMnO_{4}/H+}{→}$2R1COOH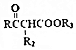 +R1OH
+R1OH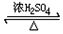 CH3CH2OOC-COOCH2CH3+2H2O.
CH3CH2OOC-COOCH2CH3+2H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
| Ksp或Ka | Ksp=1.8×10-10 | Ksp=2.0×10-12 | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
| A. | 向浓度均为1×10-4 mol/L的KCl和K2CrO4混合液中逐滴加入1×10-3 mol/LAgNO3溶液,CrO42-先沉淀(10-5 mol/L是否太小?这个浓度一般都认为沉淀完全了) | |
| B. | H2CO3、HCO3-、CH3COO-、ClO-在溶液中可以大量共存 | |
| C. | 相同浓度的CH3COONa和NaClO混合溶液,各离子浓度的大小关系为:c(Na+)>c(CH3COO-)>c(ClO-)>c(OH-)>c(H+) | |
| D. | 碳酸钠溶液中滴加少量氯水的离子方程式为:CO32-+Cl2+H2O═HCO3-+Cl-+HClO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com