
【题目】填写下列空白:
(1)将等物质的量的NH3和CH4混合,混合气体中NH3与CH4的质量比为____________。
(2)要使NH3与CH4含相同数目的H原子,则NH3和CH4的物质的量之比为__________。
(3)标准状况下,密度为0.75 g·L-1的NH3与CH4组成的混合气体中,NH3的体积分数为__________,该混合气体对氢气的相对密度为________。
(4)已知a g A和b g B恰好完全反应生成0.2 mol C和d g D,则C的摩尔质量为__________________。
(5)同温同压下,已知O2的密度为ρg/L,则CO2的密度为__________。
(6)现有下列三种气体:①32 g CH4;②约含有6.02×1023个HCl分子的氯化氢气体;③标准状况下33.6 LO2。请按物理量由小到大的顺序排列:a.质量________(填序号,下同);b.分子数目________c.相同状况下气体的体积________。
【答案】17:164:380%8.45(a+b-d)g/mol11ρ/8①②③②③①②③①
【解析】
(1).将等物质的量的NH3和CH4混合,设NH3与CH4的物质的量均为1mol,则m(NH3)=1mol×17g/mol=17g,m(CH4)=1mol×16g/mol=16g,所以混合气体中NH3与CH4的质量比为17:16,故答案为:17:16;
(2).要使NH3与CH4含有相同数目的H原子,设NH3和CH4的物质的量分别为amol、bmol,则有amol×3=4mol×b,a:b=4:3,故答案为:4:3;
(3).标准状况下,混合气体的平均摩尔质量为0.75 g·L-1×22.4L/mol=16.8g,设氨气的体积分数为x,有17x+16(1-x)=16.8,解得x=0.8,即氨气的体积分数为80%;相同条件下,该混合气体对氢气的相对密度等于其摩尔质量之比即![]() =8.4,故答案为:80%;8.4;
=8.4,故答案为:80%;8.4;
(4).已知a g A和b g B恰好完全反应生成0.2 mol C和d g D,由质量守恒可知C的质量为m(C)=(a+b-d)g,则C的摩尔质量为M(C)=![]() =5(a+b-d)g/mol,故答案为:5(a+b-d)g/mol;
=5(a+b-d)g/mol,故答案为:5(a+b-d)g/mol;
(5).同温同压下,气体的密度之比等于其摩尔质量之比,设CO2的密度为a g/L,则![]() =
=![]() =
=![]() ,解得a=
,解得a=![]() g/L,故答案为:11ρ/8;
g/L,故答案为:11ρ/8;
(6).现有下列三种气体:①32 g CH4的物质的量为32g÷16g/mol=2mol;②约含有6.02×1023个HCl分子的氯化氢气体,其物质的量为![]() =1mol,质量为1mol×36.5g/mol=36.5g;③标准状况下33.6 LO2的物质的量为33.6L÷22.4L/mol=1.5mol,质量为1.5mol×32g/mol=48g,则a.三种物质的质量由小到大的顺序为①②③,b.物质的分子个数之比等于其物质的量之比,则分子数目由小到大的顺序为②③①,c. 相同状况下气体的体积之比等于其物质的量之比,则气体的体积由小到大的顺序为②③①,故答案为:①②③;②③①;②③①。
=1mol,质量为1mol×36.5g/mol=36.5g;③标准状况下33.6 LO2的物质的量为33.6L÷22.4L/mol=1.5mol,质量为1.5mol×32g/mol=48g,则a.三种物质的质量由小到大的顺序为①②③,b.物质的分子个数之比等于其物质的量之比,则分子数目由小到大的顺序为②③①,c. 相同状况下气体的体积之比等于其物质的量之比,则气体的体积由小到大的顺序为②③①,故答案为:①②③;②③①;②③①。


科目:高中化学 来源: 题型:
【题目】浓度均为0.01mol·L-1、体积均为V1L的两种一元酸HX和HY的水溶液,加水稀释至体积为VL,测得两溶液pH随lg![]() 变化的情况如图所示,下列说法错误的是
变化的情况如图所示,下列说法错误的是
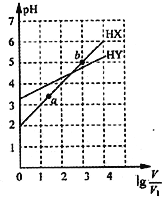
A. HY为一元弱酸 B. 将两种溶液无限稀释,由水电离产生的c(H+)相等
C. lg![]() =3时,升高温度,
=3时,升高温度,![]() 增大 D. HX 的电离程度:b>a
增大 D. HX 的电离程度:b>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】广泛用于纺织工业的连二亚硫酸钠(Na2S2O4),俗称保险粉,是一种强还原剂,可溶于水,但不溶于乙醇,在碱性介质中稳定。
Ⅰ.工业上制备连二亚硫酸钠的流程如下:

请回答下列问题:
(1)步骤①中的化学方程式为___________________________________;
(2)步骤②中沉淀为_________________________________(填化学式);
(3)步骤③中加入NaCl 固体的作用是______________________________,分离出保险粉方法为_______、洗涤、干燥,洗涤所用试剂是___________________________。
Ⅱ.工业上也可用右图装置电解NaHSO3溶液制Na2S2O4。
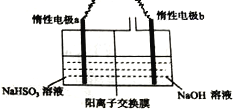
(1)惰性电极a连接电源的_________(填“正极”或“负极”),其电极反应式为________________;
(2)若不加隔膜,则得不到连二亚硫酸钠,其原因是____________________________。
Ⅲ.探究Na2S2O4的性质:
某课题小组常温下测定0.050 molL-1Na2S2O4溶液在空气中的pH变化如下图所示;
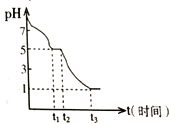
(1)0-t1段主要生成HSO3-,根据pH变化图,写出0- t1发生反应的离子方程式为______________;
(2)若t1时溶液中Na2S2O4全部被氧化成NaHSO3,此时溶液中c(SO32-)-c(H2SO3) =__________ molL-1(填具体数值,不考虑溶液体积变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:在常温下,苯(C6H6)为一种无色、透明的液体,毒性较高,易挥发,易燃,有腐蚀性,沸点为80.1℃,难溶于水,易溶于有机溶剂,可作为有机溶剂;碘(I2)为紫黑色晶体,易升华,易凝华,熔点113.5℃,沸点184.3℃,加热时碘升华为紫色蒸气,冷却后凝华成紫黑色固体。实验室常用苯来提取碘水中的碘,具体操作如下:

①向碘的水溶液中加入萃取剂苯,转移到分液漏斗中,塞上玻璃塞,充分振荡放气后(如图1);
②将分液漏斗置于铁架台的铁圈上静置(如图2);
③当分液漏斗中的液体分成清晰的两层后,经“合适的操作”将两层液体进行分离;
④将分离出的碘和苯的混合液转移到仪器A中,加入少量沸石进行蒸馏以分离苯和碘(如图3)。
请回答下列问题:
(1)分液漏斗在使用前必须进行的操作是_______。
(2)步骤③中“合适的操作”的名称是________。
(3)步骤④中采用水浴加热而不直接加热的原因是________________;图3中有多处明显的错误:a.冷却水进出方向错误.b.___________________。
(4)锥形瓶置于冰水中的目的是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于第三周期从左到右的主族元素,下列说法中不正确的是( )
A.原子半径逐渐减小
B.电子层数逐渐增多
C.最高正化合价逐渐增大
D.元素的非金属性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒氧化还原电池是一种新型可充电池,不同价态的含钒离子作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中。其结构原理如图所示,该电池放电时,右槽中的电极反应为:V2+-e-=V3+,下列说法正确的是

A. 放电时,右槽发生还原反应
B. 放电时,左槽的电极反应式:VO2++2H++e-=VO2++H2O
C. 充电时,每转移1mol电子,n(H+)的变化量为1mol
D. 充电时,阴极电解液pH升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤气中主要的含硫杂质有H2S以及COS(有机硫),煤气燃烧后含硫杂质会转化成SO2从而引起大气污染,因此煤气中H2S的脱出程度已成为煤气洁净度的一个重要指标。请回答下列问题:
(1)H2S在水溶液中的电离方程式为___________。
(2)脱除煤气中COS的方法有Br2的KOH溶液氧化法、H2还原法、水解法等。
①COS的分子结构与CO2相似,COS的结构式为___________。
②Br2的KOH溶液将COS氧化为硫酸盐的离子方程式为______________。
③已知:H2、COS、H2S、CO的燃烧热依次为285kJ/mol、299kJ/mol、586kJ/mol、283kJ/mol;H2还原COS发生的反应为H2(g)+COS(g)=H2S(g)+CO(g),该反应的ΔH=_________kJ/mol。
④用活性α-Al2O3催化COS水解反应为COS(g)+H2O(g) ![]() CO2(g)+H2S(g) ΔH<0,相同流量且在催化剂表面停留相同时间时,不同温度下COS的转化率(未达到平衡)如图1所示;某温度下,COS的平衡转化率与n(H2O)/n(COS)的关系如图2所示。
CO2(g)+H2S(g) ΔH<0,相同流量且在催化剂表面停留相同时间时,不同温度下COS的转化率(未达到平衡)如图1所示;某温度下,COS的平衡转化率与n(H2O)/n(COS)的关系如图2所示。

由图1可知,催化剂活性最大时对应的温度约为______,COS的转化率在后期下降的原因是_______________________________________。由图2可知,P点时平衡常数K=______(保留2位有效数字)。Q点转化率高于P点的原因是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质,下列实验现象和结论一 致且正确的是
A. 加入有色布条,褪色,说明溶液中有 Cl2 存在
B. 溶液呈现黄绿色,且有刺激性气味,说明有 Cl2 存在
C. 先加入盐酸酸化,再加入硝酸银溶液产生白色沉淀,说明有 Cl-存在
D. 新制氯水放置数天后酸性将减弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com