

| A. | 图①表示25℃时,向盐酸和醋酸混合溶液中滴入氨水过程中电导率(表征溶液导电能力大小的物理量)的变化关系 | |
| B. | 图②中曲线表示反应2SO2(g)+O2(g)═2SO3(g);△H<0 正、逆反应的平衡常数K随温度的变化 | |
| C. | 图③表示10mL 0.01mol•L-1 KMnO4 酸性溶液与过量的0.1mol•L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化 | |
| D. | 图④中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g);△H<0使用和未使用催化剂时,反应过程中的能量变化 |
分析 A.随着氨水的加入,溶液的导电率先增大后减小,然后不变;
B.随温度升高平衡向吸热方向移动;
C.随着反应进行,锰离子的物质的量增大,高锰酸钾完全反应后,不再改变;
D.加催化剂会降低反应所需的活化能.
解答 解:A.醋酸为弱电解质,向盐酸和醋酸混合溶液中滴入氨水,生成醋酸铵为强电解质,溶液导电性增强,而且变化为平滑的曲线不是直线,图象不符合,故A错误;
B.反应是放热反应,随温度升高平衡逆向进行,逆向反应平衡常数增大,正反应平衡常数减小,图象符合,故B正确;
C.10mL 0.01mol•L-1 KMnO4 酸性溶液与过量的0.1mol•L-1 H2C2O4溶液混合,反应生成锰离子,随着反应进行,锰离子的物质的量增大,当高锰酸钾完全反应后,n(Mn2+)不再改变,图象符合,故C正确;
D.加催化剂会降低反应所需的活化能,图中a表示的活化能小,所以a表示使用催化剂时的能量变化,图象符合,故D正确.
故选A.
点评 本题考查了溶液的导电性、化学平衡常数的影响因素、化学反应能量变化等,题目涉及的知识点较多,把握图象分析方法和平衡移动原理的判断依据是解题关键,题目难度中等.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 高铁酸钾处理水时,水发生氧化反应 | |
| B. | 湿法中每生成1mol Na2FeO4共转移3mol电子 | |
| C. | 干法中每生成1mol Na2FeO4共转移3mol电子 | |
| D. | K2FeO4处理水时,不仅能杀菌,并能使悬浮杂质沉降 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在恒容密闭容器中存在下列平衡:C(s)+H2O(g)?CO(g)+H2(g)的平衡物质的量浓度与温度 T的关系如图所示.下列说法错误的是( )
在恒容密闭容器中存在下列平衡:C(s)+H2O(g)?CO(g)+H2(g)的平衡物质的量浓度与温度 T的关系如图所示.下列说法错误的是( )| A. | 该反应的△H>0 | |
| B. | 若T1、T2 时的平衡常数分别为K1、K2,则K1=K2 | |
| C. | 通过加热可以使B 点变到C 点 | |
| D. | 在T2时若反应进行到状态D,则一定有υ(正)<υ(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液可由等体积、浓度均为0.1mol•L?1的醋酸和氨水反应得到 | |
| B. | CH3COONH4加入纯水中,水的电离程度不变 | |
| C. | 常温下,电离常数K(CH3COOH)=K(NH3•H2O) | |
| D. | 该溶液中c(CH3COO?)大于同浓度CH3COONa溶液中的c(CH3COO?) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | Q | R | T |
| 原子半径/10-10m | 0.77 | 0.74 | 0.75 | 1.17 | 0.99 | 1.10 |
| 主要化合价 | +4、-4 | -2 | +5、-3 | +4、-4 | +7、-1 | +5、-3 |
| A. | X与Y可以形成阴离子XY32- | |
| B. | Z的氢化物的沸点比T的氢化物的沸点高 | |
| C. | 元素R的氧化物对应的水化物一定为强酸 | |
| D. | 由X形成的化合物XY2和XR4,其中XR4的沸点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | a的溶解度大于b的溶解度 | |
| B. | 在t℃时,a、b的饱和溶液中溶质的物质的量浓度相同 | |
| C. | 升高温度时,a、b溶解度均增大 | |
| D. | 在t℃时,将a、b的饱和溶液升温后,溶质的质量分数:a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,A既能与强酸又能与强碱反应,且都能产生气体,则A的化学式为(NH4)2S或NH4HS.
,A既能与强酸又能与强碱反应,且都能产生气体,则A的化学式为(NH4)2S或NH4HS.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无法确定NaHA溶液的酸碱性 | |
| B. | NaHA溶液中:c(H+)=c(A2-)+c(OH-) | |
| C. | 若0.1mol/L NaHA溶液的pH=2,则0.1mol/L H2A溶液中c(H+)=0.11mol/L | |
| D. | 常温下1mol/L NaHA溶液与1mol/L NaOH溶液等体积混合所得溶液pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
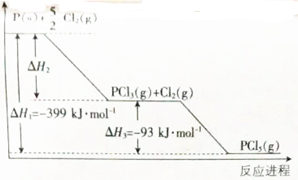
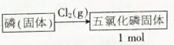

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com