
| 共价键 | 键能/ kJ•mol-1 | 共价键 | 键能/ kJ•mol-1 | 共价键 | 键能/ kJ•mol-1 |
| H-H | 436 | H-Br | 366 | Cl-Cl | 243 |
| H-O | 463 | H-I | 298 | Br-Br | 193 |
| H-Cl | 432 | O=O | 496 | I-I | 151 |
| A. | H2O中含有两个O-H共价键,故用氢气与氧气合成1 mol H2O放出的能量为926 kJ | |
| B. | 用单质合成1 mol H-Cl所放出的能量小于合成1 mol H-Br所放出的能量 | |
| C. | 当用表中卤素单质与氢气合成卤化氢时,所有的反应都是放热反应 | |
| D. | 合成溴化氢的热化学方程式为H2(g)+Br2(g)═2HBr(g)△H=+103 kJ•mol-1 |
分析 化学反应的实质是旧化学键的断裂和新化学键的形成,化学键断裂吸收能量,形成新化学键放出能量,根据共价键的断裂和形成吸收和放出的热量多少可判断反应热并计算,以此解答该题.
解答 解:A.氢气与氧气合成1 mol H2O放出的能量为2×463-(436+$\frac{1}{2}$×496)=242(kJ),故A错误;
B.用单质合成1 mol H-Cl所放出的能量为432-$\frac{1}{2}×$(436+243 )=92.5(kJ),合成1 mol H-Br所放出的能量为366-$\frac{1}{2}×$(436+193 )=51.5(kJ),故B错误;
C.卤素单质与氢气合成卤化氢为化合反应,用表中数据计算,形成化学键释放的能量大于断裂化学键吸收的能量,为放热反应,故C正确;
D.由B分析可知合成溴化氢的热化学方程式为H2(g)+Br2(g)═2HBr(g)△H=-103 kJ•mol-1,应为放热反应,故D错误.
故选C.
点评 本题考查反应热与焓变,为高频考点,侧重于学生的分析能量和计算能量的考查,解题时需审清题目,理清关系,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 由于碘在乙醇中的溶解度较大,所以可用乙醇把碘水中的碘萃取出来 | |
| B. | 可用加热蒸馏的方法使含水乙醇变为无水乙醇 | |
| C. | 由于汽油和水不互溶,因此可用分液的方法将二者分离 | |
| D. | NaCl的溶解度随温度下降而减小,所以用冷却法从热的含少量KNO3的NaCl浓溶液中分离得到纯净的NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3是钠盐 | B. | Na2CO3是含氧酸盐 | ||
| C. | Na2CO3是碳酸盐 | D. | Na2CO3是碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO42- 0.1 mol•L-1 | B. | Al3+ 0.2 mol•L-1 | ||
| C. | Cl- 0.3 mol•L-1 | D. | K+ 0.4 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化亚铁与稀盐酸反应:FeO+2H+═Fe3++H2O | |
| B. | 硫酸滴在铜片上:Cu+2H+=Cu2++H2↑ | |
| C. | 硫酸溶液和氢氧化钡溶液反应:Ba2++SO42-═BaSO4 | |
| D. | 硝酸银溶液与氯化钠溶液反应:Ag++Cl-═AgCl↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用量筒量取KMnO4溶液12.00mL | |
| B. | 测定中和热时将NaOH溶液迅速一次性倒入盛有盐酸的小烧杯中,盖好盖板 | |
| C. | 常温下,测得0.01mol/LNaHCO3溶液的pH值=12 | |
| D. | 加热蒸发FeCl3溶液,获得FeCl3固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用碱式滴定管准确量取20.00 mL的高锰酸钾溶液 | |
| B. | 用NaOH滴定盐酸时,若滴定结束时俯视刻度,会导致测定结果偏高 | |
| C. | 用NaOH滴定盐酸时,只能用酚酞作指示剂 | |
| D. | 用KMnO4滴定亚硫酸钠溶液的实验中不需要另外加入指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
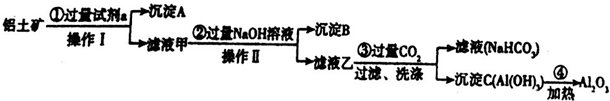
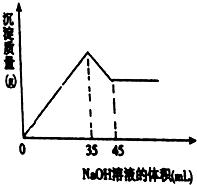
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com