
 印染工业常用亚氯酸钠(NaClO2)漂白织物.亚氯酸钠在溶液中可生成ClO2、HClO2、Cl
印染工业常用亚氯酸钠(NaClO2)漂白织物.亚氯酸钠在溶液中可生成ClO2、HClO2、Cl| O | - 2 |
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
 印染工业常用亚氯酸钠(NaClO2)漂白织物.亚氯酸钠在溶液中可生成ClO2、HClO2、ClO2,其中HClO2是漂白织物的有效成分,ClO2是有毒气体.各组分含量随pH变化情况如图所示,由图可知,使用亚氯酸钠漂白织物的最佳pH范围是( )
印染工业常用亚氯酸钠(NaClO2)漂白织物.亚氯酸钠在溶液中可生成ClO2、HClO2、ClO2,其中HClO2是漂白织物的有效成分,ClO2是有毒气体.各组分含量随pH变化情况如图所示,由图可知,使用亚氯酸钠漂白织物的最佳pH范围是( )查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省德州市高三模拟检测(一模)理综化学试卷(解析版) 题型:填空题
在自来水消毒和工业上砂糖、油脂的漂白与杀菌过程中,亚氯酸钠(NaClO2)发挥着重要的作用。下图是生产亚氯酸钠的工艺流程图:
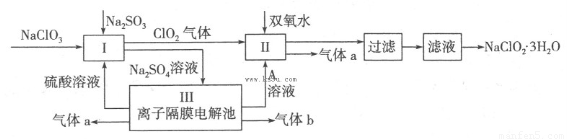
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O;
??? ②常温下,Ksp(FeS)=6.3×10-18;Ksp(CuS)=6.3×10-28;Ksp(PbS)=2.4 ×10-28
(1)反应I中发生反应的离子方程式为?????? 。
(2)从滤液中得到NaClO2·3H2O晶体的所需操作依次是?????? (填写序号)。
a.蒸馏 ?? b.蒸发浓缩?? c.过滤 ?? d.冷却结晶??? e.灼烧
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2。下表是25℃时HClO2及几种常见弱酸的电离平衡常数:
弱酸 | HClO2 | HF | H2CO3 | H2S |
Ka/mol·L-1 | 1×10-2 | 6.3×10-4 | K1=4.30×10-7 K2=5.60×10-11 | K1=9.1×10-8 K2=l.1×10-12 |
①常温下,物质的量浓度相等的NaClO2、NaF、NaHCO3、Na2S四种溶液的pH由大到小的顺序为??????? (用化学式表示);体积相等,物质的量浓度相同的NaF、NaClO2两溶液中所含阴阳离子总数的大小关系为:?????????????? (填“前者大”“相等”或“后者大”)。
②Na2S是常用的沉淀剂。某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+离子,滴加Na2S溶液后首先析出的沉淀是???????? ;常温下,当最后一种离子沉淀完全时(该离子浓度为10-5mol·L-1)此时体系中的S2-的浓度为?????????? 。
(4)Ⅲ装置中生成气体a的电极反应式?????????? ,若生成气体a的体积为1.12L(标准状况),则转移电子的物质的量为??? 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省潍坊市高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
亚氯酸钠(NaClO2)常用于水的消毒和砂糖、油脂的漂白与杀菌。以下是用过氧化氢法生产亚氯酸钠的工艺流程图:

已知:NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O。
(1)吸收塔内发生反应的化学方程式为_____________________(配平化学方程式)。该工艺流程中的NaClO3、ClO2、NaClO2都是强氧化剂,它们都能和浓盐酸反应制取Cl2。若用二氧化氯和浓盐酸制取Cl2,当生成5 mol Cl2时,通过还原反应制得氯气的质量为________克。
(2)从滤液中得到的NaClO2·3H2O晶体的操作依次是__________(填写序号)。
a.蒸馏 b.灼烧 c.过滤 d.冷却结晶
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2。下表是25℃时HClO2 及几种常见弱酸的电离平衡常数:

①常温下,物质的量浓度相等的NaClO2 、NaF、NaCN、Na2S四种溶液的pH由大到小的顺序为____________;体积相等,物质的量浓度相同的NaF、NaCN两溶液中所含阴阳离子总数的大小关系为:______________(填“前者大”“相等”或“后者大”)。
②Na2S是常用的沉淀剂。某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+ 离子,滴加Na2S溶液后首先析出的沉淀是_______;当最后一种离子沉淀完全时(该离子浓度为10-5mol·L-1)此时的S2-的浓度为____。
已知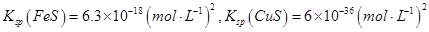

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com