
ŌŚŅ»¶ØĢõ¼žĻĀ£¬C(s)£«H2O(g)CO£«H2(g)””¦¤H£¾0ŌŚŅ»ČŻ»ż¹Ģ¶ØµÄĆܱÕČŻĘ÷ÖŠ·ÅČė×ćĮæµÄ½¹ĢæÓėŅ»¶ØĮæµÄĖ®ÕōĘų½ųŠŠ·“Ó¦£¬ĻĀĮŠÓŠ¹ŲĶ¼ĻńÕżČ·µÄŹĒ(””””)
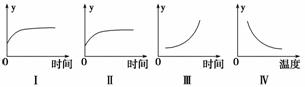
A£®¢ń Ķ¼±ķŹ¾·“Ó¦½ųŠŠ¹ż³ĢÖŠĘųĢåĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæµÄ±ä»Æ
B£®¢ņĶ¼±ķŹ¾·“Ó¦½ųŠŠ¹ż³ĢÖŠĘųĢåĆܶȵıä»Æ
C£®¢óĶ¼±ķŹ¾·“Ó¦“ļµ½Ę½ŗāŗó£¬ŅĘČ„²æ·Ö½¹ĢæŗóĖ®ÕōĘųµÄ°Ł·Öŗ¬ĮæµÄ±ä»Æ(ŗöĀŌ±ķĆ껿µÄÓ°Ļģ)
D£®¢ōĶ¼±ķŹ¾·“Ó¦“ļµ½Ę½ŗāŗó£¬ÉżøßĪĀ¶ČCOµÄ°Ł·Öŗ¬ĮæµÄ±ä»Æ

| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŅŃÖŖČČ»Æѧ·½³ĢŹ½£ŗSO2(g)+  O2(g)
O2(g) 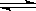 SO3(g) ”÷H = ØD98.32kJ£Æmol£¬ŌŚČŻĘ÷ÖŠ³äČė2molSO2ŗĶ1molO2³ä·Ö·“Ó¦£¬×īÖշųöµÄČČĮæĪŖ
SO3(g) ”÷H = ØD98.32kJ£Æmol£¬ŌŚČŻĘ÷ÖŠ³äČė2molSO2ŗĶ1molO2³ä·Ö·“Ó¦£¬×īÖշųöµÄČČĮæĪŖ
A”¢ 196.64kJ B”¢ 196.64kJ£Æmol
C”¢ £¼196.64kJ D”¢ £¾196.64kJ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĆŌµüĻćĖįŹĒ“Ó·ä»ØŹōÖ²ĪļÖŠĢįČ”µĆµ½µÄĖįŠŌĪļÖŹ£¬Ęä½į¹¹¼ņŹ½ČēĶ¼ĖłŹ¾”£ĻĀĮŠŠšŹöÕżČ·µÄŹĒ(””””)
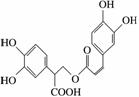
A£®ĆŌµüĻćĖįÓėäåµ„ÖŹÖ»ÄÜ·¢ÉśČ”“ś·“Ó¦
B£®1 molĆŌµüĻćĖį×ī¶ąÄÜŗĶ9 mol ĒāĘų·¢Éś¼Ó³É·“Ó¦
C£®ĆŌµüĻćĖįæÉŅŌ·¢ÉśĖ®½ā·“Ó¦”¢Č”“ś·“Ó¦ŗĶõ„»Æ·“Ó¦
D£®1 molĆŌµüĻćĖį×ī¶ąÄÜŗĶ5 mol NaOH·¢Éś·“Ó¦
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ČēĻĀĮ÷³ĢÖŠa”¢b”¢c”¢d”¢e”¢fŹĒĮłÖÖÓŠ»śĪļ£¬ĘäÖŠaŹĒĢžĄą£¬ĘäÓąŹĒĢžµÄŃÜÉśĪļ£¬ĻĀĮŠÓŠ¹ŲĖµ·ØÕżČ·µÄŹĒ (””””)
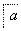


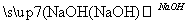


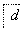
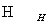
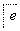

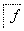
A£®ČōaµÄĻą¶Ō·Ö×ÓÖŹĮæŹĒ42£¬ŌņdŹĒŅŅČ©
B£®ČōdµÄĻą¶Ō·Ö×ÓÖŹĮæŹĒ44£¬ŌņaŹĒŅŅČ²
C£®ČōaĪŖ±½ŅŅĻ©(C6H5—CH===CH2)£¬ŌņfµÄ·Ö×ÓŹ½ŹĒC16H32O2
D£®ČōaĪŖµ„Ļ©Ģž£¬ŌņdÓėfµÄ×ī¼ņŹ½Ņ»¶ØĻąĶ¬
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
T ”ꏱ£¬ŌŚ1 LµÄĆܱÕČŻĘ÷ÖŠ³äČė2 mol CO2ŗĶ6 mol H2£¬·¢Éś·“Ó¦£ŗCO2(g)£«3H2(g)CH3OH(g)£«H2O(g)””¦¤H£½£49.0 kJ”¤mol£1£¬²āµĆH2ŗĶCH3OH(g)µÄÅضČĖꏱ¼ä±ä»ÆĒéæöČēĻĀĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ(””””)
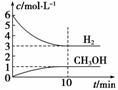
A£®0”«10 minÄŚv(H2)£½0.3 mol”¤L£1”¤min£1
B£®T ”ꏱ£¬Ę½ŗā³£ŹżK£½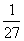 £¬CO2ÓėH2µÄ×Ŗ»ÆĀŹĻąµČ
£¬CO2ÓėH2µÄ×Ŗ»ÆĀŹĻąµČ
C£®T ”ꏱ£¬µ±ÓŠ32 g CH3OHÉś³ÉŹ±£¬·Å³ö49.0 kJµÄČČĮæ
D£®“ļµ½Ę½ŗāŗó£¬ÉżøßĪĀ¶Č»ņŌŁ³äČėCO2ĘųĢ壬¶¼æÉŅŌĢįøßH2µÄ×Ŗ»ÆĀŹ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
»ÆŃ§Ę½ŗāדĢ¬¢ń”¢¢ņ”¢¢óµÄĻą¹ŲŹż¾ŻČēĻĀ±ķ£ŗ
| ±ąŗÅ | »Æѧ·½³ĢŹ½ | Ę½ŗā³£Źż | ĪĀ¶Č | |
| 979 K | 1 173 K | |||
| ¢ń | Fe(s)£«CO2(g)FeO(s)£«CO(g) | K1 | 1.47 | 2.15 |
| ¢ņ | CO(g)£«H2O(g)CO2(g)£«H2(g) | K2 | 1.62 | b |
| ¢ó | Fe(s)£«H2O(g)FeO(s)£«H2(g) | K3 | a | 1.68 |
øł¾ŻŅŌÉĻŠÅĻ¢ÅŠ¶Ļ£¬ĻĀĮŠ½įĀŪ“ķĪóµÄŹĒ(””””)
A£®a£¾b
B£®Ōö“óŃ¹Ēæ£¬Ę½ŗāדĢ¬¢ņ²»ŅʶÆ
C£®ÉżøßĪĀ¶Č£¬Ę½ŗāדĢ¬¢óĻņÕż·“Ó¦·½ĻņŅʶÆ
D£®·“Ó¦¢ń”¢¢ó¾łĪŖ·ÅČČ·“Ó¦
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠĮ½ÖÖ·½°øÖʱøĒāŃõ»ÆĀĮ£ŗ
¢ń.2.7 g Al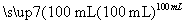 XČÜŅŗ
XČÜŅŗ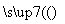 ĒāŃõ»ÆĀĮ
ĒāŃõ»ÆĀĮ
¢ņ.2.7 g Al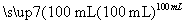 YČÜŅŗ
YČÜŅŗ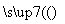 ĒāŃõ»ÆĀĮ
ĒāŃõ»ÆĀĮ
ŅŃÖŖĖłÓƵÄĻ”ŃĪĖįÓėĒāŃõ»ÆÄĘČÜŅŗ¾łĪŖ3 mol”¤L£1”£ĻĀĶ¼ŹĒĻņXČÜŅŗÓėYČÜŅŗÖŠ·Ö±š¼ÓČėĒāŃõ»ÆÄĘČÜŅŗ»ņĻ”ŃĪĖįŹ±²śÉś³ĮµķµÄÖŹĮæÓė¼ÓČėČÜŅŗĢå»żÖ®¼äµÄ¹ŲĻµ”£(»ģŗĻŗóĢå»ż±ä»ÆŗöĀŌ²»¼Ę)ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ(””””)
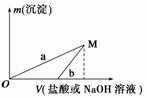
A£®aĒśĻß±ķŹ¾µÄŹĒĻņYČÜŅŗÖŠ¼ÓČėĻ”ŃĪĖį
B£®·½°ø¢ņ±Č·½°ø¢ńÉś³Éøü¶ąµÄĘųĢå
C£®ŌŚMµćŹ±£¬Į½·½°øÖŠĖłµĆČÜŅŗµÄČÜÖŹÖŹĮæ·ÖŹżĻąĶ¬
D£®MµćŅŌŗó£¬a”¢bĮ½ĢõĒśĻß½«ÖŲŗĻĪŖŅ»Ģõ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŗĻ½šÖüĒā²ÄĮĻ¾ßÓŠÓÅŅģµÄĪüŹÕĒāŠŌÄÜ£¬ŌŚÅäŗĻĒāÄܵÄæŖ·¢ÖŠĘšµ½ÖŲŅŖ×÷ÓĆ”£
£Ø1£©Ņ»¶ØĪĀ¶ČĻĀ£¬Ä³ÖüĒāŗĻ½š£ØM£©µÄÖüĒā¹ż³ĢČēĶ¼ĖłŹ¾£¬×ŻÖįĪŖĘ½ŗāŹ±ĒāĘųµÄŃ¹Ēæ£Øp£©£¬ŗįÖį±ķŹ¾¹ĢĻąÖŠĒāŌ×ÓÓė½šŹōŌ×ÓµÄøöŹż±Č£ØH/M£©”£

ŌŚOA¶Ī£¬ĒāČܽāÓŚMÖŠŠĪ³É¹ĢČÜĢåMHx£¬Ėę×ÅĒāĘųŃ¹ĒæµÄŌö“ó£¬H/MÖš²ŃŌö“ó£»ŌŚAB¶Ī£¬MHxÓėĒāĘų·¢ÉśĒā»Æ·“Ӧɜ³ÉĒā»ÆĪļMHy£¬Ēā»Æ·“Ó¦·½³ĢŹ½ĪŖ£ŗzMHx(s)+H2(g)==ZMHy(s) ”÷H(¢ń)£»ŌŚBµć£¬Ēā»Æ·“Ó¦½įŹų£¬½ųŅ»²½Ōö“óĒāĘųŃ¹Ē棬H/M¼øŗõ²»±ä”£·“Ó¦£Ø¢ń£©ÖŠz=_____£ØÓĆŗ¬xŗĶyµÄ“śŹżŹ½±ķŹ¾£©”£ĪĀ¶ČĪŖT1Ź±£¬2gijŗĻ½š4minÄŚĪüŹÕĒāĘų240mL£¬ĪüĒāĖŁĀŹv=______mL•g-1•min”£·“Ó¦µÄģŹ±ä”÷H¢ń_____0£ØĢī”°>”±”°<”±»ņ”°=”±£©”£
£Ø2£©¦Ē±ķŹ¾µ„Ī»ÖŹĮæÖüĒāŗĻ½šŌŚĒā»Æ·“Ó¦½×¶ĪµÄ×ī“óĪüĒāĮæÕ¼Ęä×ÜĪüĒāĮæµÄ±ČĄż£¬ŌņĪĀ¶ČĪŖT1”¢T2Ź±£¬¦Ē£ØT1£©____ ¦Ē£ØT2£©£ØĢī”°>”±”°<”±»ņ”°=”±£©”£µ±·“Ó¦£Ø¢ń£©“¦ÓŚĶ¼ÖŠaµćŹ±£¬±£³ÖĪĀ¶Č²»±ä£¬ĻņŗćČŻĢåĻµÖŠĶØČėÉŁĮæĒāĘų£¬“ļµ½Ę½ŗāŗó·“Ó¦£Ø¢ń£©æÉÄÜ“¦ÓŚĶ¼ÖŠµÄ_____µć£ØĢī”°b”±”°c”±»ņ”°d”±£©£¬øĆÖüĒāŗĻ½šæÉĶعż______»ņ_______µÄ·½Ź½ŹĶ·ÅĒāĘų”£
£Ø3£©ÖüĒāŗĻ½šThNi5æÉ“ß»ÆÓÉCO”¢H2ŗĻ³ÉCH4µÄ·“Ó¦£¬ĪĀ¶ČĪŖTŹ±£¬øĆ·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ĪŖ_________”£ŅŃÖŖĪĀ¶ČĪŖTŹ±£ŗCH4(g)+2H2O=CO2(g)+4H2(g) ”÷H=+165KJ•mol
CO(g)+H2O(g)=CO2(g)+H2(g) ”÷H=-41KJ•mol
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
25 ”ꏱ£¬PbCl2¹ĢĢåŌŚ²»Ķ¬ÅضČŃĪĖįÖŠµÄČܽā¶ČĒśĻßČēĶ¼”£ŌŚÖʱøPbCl2µÄŹµŃéÖŠ£¬Ļ“µÓPbCl2¹ĢĢå×īŗĆŃ”ÓĆ(””””)
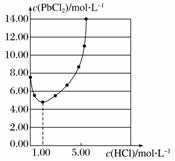
A£®ÕōĮóĖ®
B£®1.00 mol·L£1ŃĪĖį
C£®5.00 mol·L£1ŃĪĖį
D£®10.00 mol·L£1ŃĪĖį
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com