
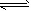 CH3COOH + OH-
CH3COOH + OH-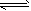 NH4OH + H+
NH4OH + H+ 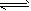 H2S+2OH-
H2S+2OH- 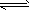 H3O++CO32-
H3O++CO32- 科目:高中化学 来源: 题型:阅读理解
 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:| c(CH3OH) |
| c(CO)×c2(H2) |
| c(CH3OH) |
| c(CO)×c2(H2) |
| 2nB |
| 3tB |
| 2nB |
| 3tB |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
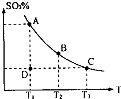 (1)在硫酸生产中,SO2催化氧化生成SO3是反应的关键,其反应的化学方程式为:2SO2(g)+O2(g)?2SO2(g),反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题:
(1)在硫酸生产中,SO2催化氧化生成SO3是反应的关键,其反应的化学方程式为:2SO2(g)+O2(g)?2SO2(g),反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题:| Kw |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖南省益阳市一中高二上学期期末考试理科化学试卷(带解析) 题型:填空题
(20分)选修四模块的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:
(1) 一定温度下,在一个固定容积的密闭容器中,可逆反应 A(g) +2B(g)  4C (g) △H >0 达到平衡时,c(A) ="2" mol·L-1,c ( B) =" 7" mol·L-1,c ( C) =" 4" mol·L-1。试确定B的起始浓度c (B)的取值范围是 ;若改变条件重新达到平衡后体系中C的质量分数增大,下列措施可行的是 。
4C (g) △H >0 达到平衡时,c(A) ="2" mol·L-1,c ( B) =" 7" mol·L-1,c ( C) =" 4" mol·L-1。试确定B的起始浓度c (B)的取值范围是 ;若改变条件重新达到平衡后体系中C的质量分数增大,下列措施可行的是 。
A. 增加C的物质的量 B. 加压
C. 升温 D.使用催化剂
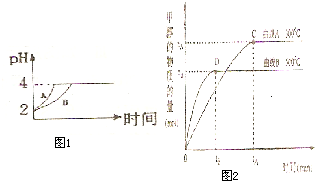
(2)常温下,取 pH=2的盐酸和醋酸溶液各100mL, 向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如右图所示。则图中表示醋酸溶液中pH变化曲线的是 ( 填“A”或“B”)。 设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为 m2。 则
m1 m2 ( 选填“<”、“=”、“>”)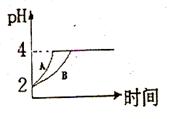
(3) 在体积为3L的密闭容器中,CO与H2在一定条件下反应生成甲醇:CO ( g) + 2H2( g) → CH3OH(g) ΔH= —91kJ·mol-1。反应达到平衡时,平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
(4) 难溶电解质在水溶液中也存在溶解平衡。在常温下,溶液里各离子浓度以它们化学计量数为方次的乘积是一个常数,叫溶度积常数。例如: Cu(OH)2(s) Cu2+ (aq) + 2OH - ( aq),Ksp =" c" (Cu2+ ) c 2(OH - ) =" 2×10" -20。当溶液中各离子浓度计量数方次的乘积大于溶度积时,则产生沉淀。若某CuSO4溶液里c( Cu2+) ="0.02" mol·L-1,如果生成Cu(OH)2沉淀,应调整溶液pH,使pH大于 ; 要使0.2 mol·L-1的CuSO4溶液中Cu2+沉淀较为完全 ( 使Cu2+浓度降至原来的万分之一)则应向溶液里加NaOH溶液,使溶液pH等于 。
Cu2+ (aq) + 2OH - ( aq),Ksp =" c" (Cu2+ ) c 2(OH - ) =" 2×10" -20。当溶液中各离子浓度计量数方次的乘积大于溶度积时,则产生沉淀。若某CuSO4溶液里c( Cu2+) ="0.02" mol·L-1,如果生成Cu(OH)2沉淀,应调整溶液pH,使pH大于 ; 要使0.2 mol·L-1的CuSO4溶液中Cu2+沉淀较为完全 ( 使Cu2+浓度降至原来的万分之一)则应向溶液里加NaOH溶液,使溶液pH等于 。
(5) 常温下,某纯碱(Na2CO3) 溶液中滴入酚酞,溶液呈红色。则该溶液呈 性。在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH 所致;乙同学认为是溶液中Na2CO3电离出的CO32-水解所致。请你设计一个简单的实验方案用来评判甲乙两位同学的观点是否正确(包括操作、现象和结论) 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年陕西省西安市高三第一次质检化学试卷(解析版) 题型:计算题
(1)在硫酸生产中,SO2催化氧化生成SO3是反应的关键,其反应的化学方程式为: ,反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题:
,反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题:

①反应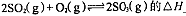 0(填“>”或“<”)。若在恒温恒容条件下,上述反应达到平衡,再给该平衡体系中通入SO3气体,容器内的压强 (填“增大”、“减小”或“不变”),平衡 移动(填“向正反应方何”、“逆反应方向’或“不”)若在恒温恒压条件下,上述反应达到平衡,再给该平衡体系中通人大量氮气后,体系重新达到平衡,此平衡与原平衡相比较,SO2的物质的量 __(填“增大”、“减小”或“不变”),O2的物质的量浓度
(填“增大”、“减小”或“不变”)。
0(填“>”或“<”)。若在恒温恒容条件下,上述反应达到平衡,再给该平衡体系中通入SO3气体,容器内的压强 (填“增大”、“减小”或“不变”),平衡 移动(填“向正反应方何”、“逆反应方向’或“不”)若在恒温恒压条件下,上述反应达到平衡,再给该平衡体系中通人大量氮气后,体系重新达到平衡,此平衡与原平衡相比较,SO2的物质的量 __(填“增大”、“减小”或“不变”),O2的物质的量浓度
(填“增大”、“减小”或“不变”)。
②若温度为T1、 T2,反应的平衡常数分别为K1、K2 则K1 K2(填“>”、“<”或“=”),反应进行到D点状态时,V正 V逆(填“>”、“<”或“=”)
③在一个固定容积为5L的密闭容器中充入0.20 mol SO2和0.10 mol O2,在500℃开始反应,半分钟达到平衡,测得容器内含SO3 0.18 mol,则v(O2)= mol·L-1·min-1,若继续通入0.20 mol SO2和0.10 mol O2,平衡发生了移动,再次达到平衡后, mol<n(SO3)< mol.
(2)已知三种无色溶液:a.NaHCO3溶液,b.AlCl3溶液,c.NaAlO2溶液,它们两两反应均能生成Al(OH)3沉淀。请回答下列问题:
①两种溶液恰好完全反应,所得溶液中c(OH—)= 是水的离子积),则这两种溶液可为 (填字母)。
是水的离子积),则这两种溶液可为 (填字母)。
②能体现出NaHCO3在反应中,HCO—3的水解程度小于电离程度的离于方程式为 。
查看答案和解析>>
科目:高中化学 来源:2013届山东省潍坊市高二寒假作业化学(三)试卷 题型:填空题
(Ⅰ)化学平衡移动原理,同样也适用于其他平衡
(1)已知在氨水中存在下列平衡:NH3+H2O NH3·H2O
NH3·H2O
 NH+OH-
NH+OH-
向氨水中加入MgCl2固体时,平衡向 移动,OH-的浓度
向浓氨水中加入少量NaOH固体,平衡向 移动,此时发生的现象是___________。
(2)氯化铁水解的离子方程式为___________________,向氯
化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐溶解,并产生无色气体,其离子方程
式为________________,同时有红褐色沉淀生成,其原因是
_ ___________________________________________________________。
(3)向Mg(OH)2的悬浊液中加入NH4Cl溶液,现象 ,原
因为
。
(Ⅱ)某二元酸 H2A 的电离方程式是:H2A=H++HA,HA- A2-+H+。回答下列问题:
A2-+H+。回答下列问题:
(1)H2A是 (填“强电解质”或“弱电解质”或“非电解质”)
(2)Na2A 溶液显 (填“酸性”、“碱性”或“中性”),理由是(用离子方
程式表示) ;
(3)NaHA 溶液显 (填“酸性”、“碱性”或“中性”),理由是(用离子方
程式表示) ;
(4)若 0.1mol·L-1NaHA 溶液的 pH=2,则 0.1mol·L-1 H2A溶液中氢离子的物质
的量浓度可能 0.11mol·L(填“<”、“>”或“=”),理由是: ;
(5)0.1mol·L NaHA溶液中各离子浓度由大到小的顺序是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com