
【题目】为测定乙醇的结构式,有人设计了用无水酒精与钠反应的实验装置和测定氢气体积的装置进行实验。可供选用的实验仪器如图所示。
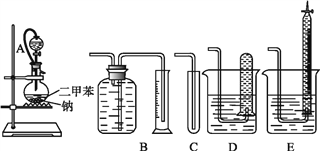
请回答以下问题:
(1)测量氢气体积的最好装置是_____(填编号)。
(2)装置中A部分的分液漏斗与烧瓶之间连接的导管所起的作用是___(填编号)。
A.防止无水酒精挥发
B.保证实验装置不漏气
C.使无水酒精顺利滴下
(3)实验前预先将小块钠在二甲苯中熔化成若干个小钠珠,冷却后倒入烧瓶中,其目的是____。
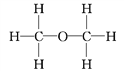
(4)已知无水酒精的密度为0.789 g·cm3,移取2.0 mL酒精,反应完全后(钠过量),收集到390 mL(视作标准状况)气体。则一个乙醇分子中能被钠取代的氢原子数为___,由此可确定乙醇的结构式为_________,而不是_________。
【答案】B C 增大无水乙醇与钠的接触面积,使之充分反应 1 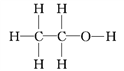
【解析】
(1)氢气不溶于水,可用排水法测量氢气的体积。使用B、D、E装置均可以,D装置操作不方便,E测量读数最准确,但容积受限。
(2)分液漏斗中的溶液只有在一定压强下才能顺利滴下。产生的气体沿导管进入分液漏斗中,对溶液产生压力,能够使分液漏斗内的液体顺利滴下。
(3)要准确测定乙醇和钠反应生成的氢气与乙醇的关系,钠必须过量。又因为钠的化学性质很活泼,容易与空气中的氧气、水蒸气发生反应,做实验时预先将小块钠在二甲苯中熔化成若干个小钠珠,目的是防止钠与空气反应干扰实验,同时增大乙醇与钠的接触面积,增大反应速率;
(4)乙醇的质量为:m(C2H6O)=2.0mL×0.789g·cm-3=1.578g,则乙醇的物质的量为:n(C2H6O)=1.578g÷46g·mol-1=0.0343mol,由于0.0343mol C2H6O与过量的Na完全反应可以生成0.390LH2,则1.00mol C2H6O与Na反应能生成11.37LH2,约为0.5molH2,也就是约为1molH,即1个C2H6O分子中,只有1个H可以被Na置换,这说明C2H6O分子里的6个H中,有1个与其他5个是不同的,乙醇的结构式为 ,而不是
,而不是 。
。


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:
【题目】Cl2O能与水反应生成次氯酸,可杀死新型冠状病毒等多种病毒。一种制备Cl2O原理为HgO(红色粉末)+2Cl2=HgCl2(白色粉末)+Cl2O,某化学小组用下图装置制备Cl2O(夹持装置略去)
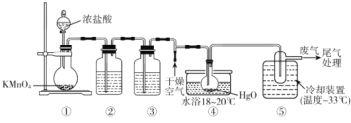
已知:①Cl2O的熔点为-116°C、沸点为3.8°C,易溶于水;②高浓度的Cl2O易爆炸,Cl2O与有机物接触或加热时会发生剧烈反应。
下列说法错误的是
A.装置③中盛装的试剂是饱和食盐水,④中现象是红色粉末逐渐变为白色
B.装置④中橡胶塞用锡箔包裹,防止Cl2O与橡胶塞反应
C.从装置⑤中逸出气体的主要成分是Cl2O
D.通入干燥空气的目的是将生成的Cl2O稀释,防止发生爆炸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用AgNO3溶液分别滴定浓度均为0.01mol/L的KCl、K2C2O4溶液,所得的沉淀溶解平衡图象如图所示(不考虑![]() 的水解,pAg=
的水解,pAg=![]() lgc(Ag+)),下列说法正确的是
lgc(Ag+)),下列说法正确的是

A.KspAg2C2O4的数量级等于10-10
B.n点表示AgCl的过饱和溶液
C.向c(Cl-)=c(![]() )的混合液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀
)的混合液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀
D.Ag2C2O4+2Cl-![]() 2AgCl+
2AgCl+![]() 的平衡常数为103.29
的平衡常数为103.29
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个2L的密闭容器中,投入反应物,发生反应2SO3(g)![]() 2SO2(g)+O2(g) ΔH>0,其中SO3的变化如下图所示:
2SO2(g)+O2(g) ΔH>0,其中SO3的变化如下图所示:
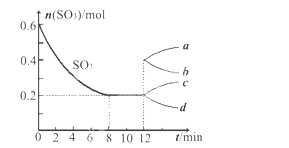
(1)写出该反应的平衡常数表达式并根据8min时到达平衡计算出结果________________。
(2)用O2表示0到8min内该反应的平均速率v=__________________。
(3)升高温度,该反应的K值将______;容器中气体的平均相对分子质量将______。(填“增大”“减小”或“不变”)
(4)能说明该反应已达到平衡状态的是________。
A.v(SO3)=2v(O2) B.容器内压强保持不变
C.v(SO2)逆=2v(O2)正 D.容器内密度保持不变
(5)在第12min时,容器压缩到1L,则SO3的变化曲线为_______。
A.a B.b C.c D.d
(6)若保持容积不变在第12min时,加入SO3(g),则平衡向_______反应方向移动(填“正” 或“逆”)。SO3的体积分数_______(填“增大”或“减小”)。
(7)将相同物质的量的SO3充入下面的两个容器中,已知甲容器有活塞可以上下移动,乙容器体积固定,在相同的温度、压强下开始发生反应,在反应过程中维持体系温度不变。

①反应达平衡所需时间甲________乙(填“大于”“等于”或“小于”);达平衡时SO3的转化率甲__________乙(“大于”“等于”或“小于”)。
②若平衡后,向甲、乙中分别充入惰性气体,__________(填“甲”或“乙”)容器的平衡将向__________(填“正”或“逆”)反应方向移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按照课本实验要求,用50mL0.50mol/L的盐酸于50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量计算中和热,下列说法中,正确的是( )
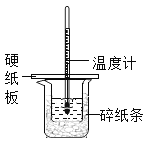
A. 烧杯间填满碎纸条的作用是固定小烧杯
B. 用如图装置可以完成中和热测定的实验
C. 为防止混合溶液时溅出产生误差,因此混合时速度要慢
D. 若将盐酸体积改为60mL,不考虑热量损失,理论上所求中和热相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯吡格雷是一种用于预防和治疗因血小板高聚集引起的心、脑及其他动脉循环障碍疾病的药物。以A为原料合成该药物的路线如图:

(1)A的化学名称是__,C中的官能团除了氯原子,其他官能团名称为__。
(2)A分子中最少有__原子共面。
(3)C生成D的反应类型为__。
(4)A与新制Cu(OH)2反应的化学方程式为__。
(5)物质G是物质A的同系物,比A多一个碳原子,符合以下条件的G的同分异构体共有__种。
①除苯环之外无其他环状结构;②能发生银镜反应。③苯环上有只有两个取代基。
其中核磁共振氢谱中有4个吸收峰,且峰值比为2∶2∶2∶1的结构简式为__。
(6)已知:
![]()
![]()
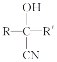 ,写出以苯甲醇为有机原料制备化合物
,写出以苯甲醇为有机原料制备化合物 的合成路线(无机试剂任选)__。
的合成路线(无机试剂任选)__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类比pH的定义,对于稀溶液可以定义pC(X)=-lgc(X),pKa=-lgKa,常温下,某浓度H2A溶液在不同pH下,测得pC(H2A)、pC(HA-)、pC(A2-)变化如图所示,下列说法正确的是
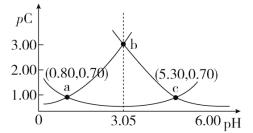
A.随着pH的增大,pC增大的曲线是A2-的物质的量浓度的负对数
B.pH=4.50时,c(HA-)>c(A2-)=c(H2A)
C.b点时,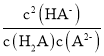 =104.50
=104.50
D.pH=3.00~5.30时,c(H2A)+c(HA-)+c(A2-)先减小后增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁粉和氧化亚铁粉末的混合物共9.2克,加入到150毫升的稀硫酸中,恰好完全反应,得到氢气2.24升(标准状况)。求:
(1)混合物中铁的质量?___
(2)原稀硫酸的物质的量浓度?___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
①向50mL小烧杯中加入20mL饱和FeCl3溶液并加热煮沸,制备氢氧化铁胶体
②家庭的厨卫管道内常因留有油脂、毛发、菜渣、纸棉纤维等而造成堵塞,此时可用固体管道疏通剂疏通,其主要成分为铝和氢氧化钠
③打印机(或复印机)使用的墨粉中的铁的氧化物是氧化铁
④“绿色化学”就是在生产结束后及时治理污染
⑤食品中适量添加二氧化硫可以达到去色、杀菌、抗氧化的作用
⑥对于可逆反应2HI(g)![]() H2(g) +I2(g) ΔH<0,若将反应体系降温至室温,反应正向移动,可以从温度分析对该平衡的影响
H2(g) +I2(g) ΔH<0,若将反应体系降温至室温,反应正向移动,可以从温度分析对该平衡的影响
A.②⑤⑥B.①③⑥C.②⑤D.③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com