
| A. | ⅠA族的元素全部都是金属元素 | |
| B. | 元素周期表与18个纵行,即有18个族 | |
| C. | 同周期中的IA族元素的金属性比ⅡA族元素的金属性强 | |
| D. | 元素周期表中右上方区域的元素多用于制造半导体材料 |
分析 A、IA族包含碱金属与氢元素;
B、元素周期表含有7个主族、7个副族、1个零族、1个第Ⅷ族;
C、同周期ⅠA族元素的金属性一定比ⅡA族元素的金属性强;
D、半导体材料元素既有金属性,又有非金属性,应在金属与非金属交界处.
解答 解:A、IA族包含碱金属与氢元素,氢元素属于非金属元素,故A错误;
B、元素周期表含有7个主族、7个副族、1个零族、1个第Ⅷ族,共有16个族,故B错误;
C、同周期ⅠA族元素的金属性一定比ⅡA族元素的金属性强,不为同周期关系时,金属性强弱不一定,故C正确;
D、金属元素和非金属元素分界线附近的意元素多为半导体材料元素,右上方区域的非金属元素都是绝缘体材料元素,故D错误;
故选C.
点评 本题考查了学生对元素周期表的熟悉程度,明确位置与性质的关系是解答的关键,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 瓶中气体的黄绿色逐渐变浅,内壁有油状液滴形成 | |
| B. | 若日光直射可能发生爆炸 | |
| C. | 甲烷与氯气发生了取代反应 | |
| D. | 生成物只有 CH3Cl、CH2Cl2、CHCl3、CCl4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
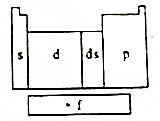 在研究原子核外电子排布与元素周期表的关系时,人们发现价电子排布相似的元素集中在一起,据此,人们将元素周期表分为五个区,并以最后填入电子的轨道能级符号作为该区的符号,如图所示.
在研究原子核外电子排布与元素周期表的关系时,人们发现价电子排布相似的元素集中在一起,据此,人们将元素周期表分为五个区,并以最后填入电子的轨道能级符号作为该区的符号,如图所示.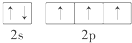 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的电子式: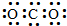 | B. | 乙烯的比例模型: | ||
| C. | 醋酸钠的分子式:C2H3O2Na | D. | C原子最外层电子的轨道表示式: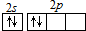 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO4 H2SO4 AlCl3 BaCl2 | B. | HCl NaOH K2SO4 NaHCO3 | ||
| C. | AlCl3 KHCO3 NaCl Na2SO4 | D. | NaOH FeCl3 MgCl2 K2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com