
| A. | CaO+H2O═Ca(OH)2 | B. | CO2+C $\frac{\underline{\;高温\;}}{\;}$ 2CO | ||
| C. | CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O | D. | NaOH+HCl═NaCl+H2O |
分析 依据化学反应能量守恒,生成物所贮的化学能比反应物所贮化学能要多,说明该反应为吸热反应.
解答 解:A.CaO+H2O=Ca(0H)2 属于放热反应,生成物所贮的化学能比反应物所贮化学能要少,故A不符合;
B.C+CO2$\frac{\underline{\;高温\;}}{\;}$2CO为吸热反应,生成物所贮的化学能比反应物所贮化学能要多,故B符合;
C.CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O是燃烧反应,属于放热反应,生成物所贮的化学能比反应物所贮化学能要少,故C不符合;
D.NaOH+HCl═NaCl+H2O,中和反应是放热反应,生成物所贮的化学能比反应物所贮化学能要少,故D不符合;
故选B.
点评 本题考查了化学反应能量变化,吸热放热的判断依据,掌握基础是关键,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | 滴定终点时溶液由无色变为浅红色且保持半分钟颜色不变 | |
| B. | 滴定终点时混合溶液的pH=7 | |
| C. | 滴定终点时反应的热效应即为中和热 | |
| D. | 滴定终点时两者恰好完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯与氯气在光照下反应主要生成2,4,6-三氯甲苯 | |
| B. | 苯乙烯在一定条件下催化加氢可生成乙基环己烷 | |
| C. | 乙烯与溴水反应生成1,2-二溴乙烷 | |
| D. | 苯与浓硝酸、浓硫酸共热并保持55~60℃反应生成硝基苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,3.36 L氟化氢中含有的电子数目为1.5NA | |
| B. | 常温常压下,7.0 g乙烯与丙烯的混合物中含有共用电子对的数目为1.5NA | |
| C. | 标准状况下,22.4 L己烷中含共价键数目为19 NA | |
| D. | 18 g D2O和18 g H2O中含有的质子数均为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
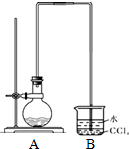 溴苯是一种常用的化工原料,通常情况下为无色油状液体,不溶于水,溶于多数有机溶剂.沸点156.2℃,较难挥发.某同学拟用如下装置制备溴苯(已检查气密性):
溴苯是一种常用的化工原料,通常情况下为无色油状液体,不溶于水,溶于多数有机溶剂.沸点156.2℃,较难挥发.某同学拟用如下装置制备溴苯(已检查气密性): .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热NH4Cl只破坏离子键 | |
| B. | 4.48L氨气中含有0.6NA个N-H键 | |
| C. | PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构 | |
| D. | 某元素最高价氧化物的水化物和氢化物的化学式分别为H2XO4、H2X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF、HCl、HBr、HI的热稳定性依次减弱 | |
| B. | 水结成冰体积膨胀,密度变小 | |
| C. | NH3易液化 | |
| D. | 在相同条件下,H2O的沸点比H2S的沸点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com