
【题目】如表是甲、乙、丙、丁四种有机物的有关信息;
甲 | ①能使溴的四氯化碳溶液褪色;②产量是衡量国家石油化工水平的重要标志; ③能与水在一定条件下反应生成丙 |
乙 | ①由C、H两种元素组成;②球棍模型为 |
丙 | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与丁反应生成戊 |
丁 | ①由C、H、O三种元素组成;②球棍模型为 |
根据表中信息回答下列问题:
(1)写出实验室制备甲的化学方程式;
(2)乙与液溴反应的化学方程式为;
(3)丙与丁反应能生成戊,戊为相对分子质量为100的酯,该反应类型为 , 其化学反应方程式为;
(4)写出符合下列条件的戊的同分异构体的结构简式:;
I.分子中存在两个相同甲基并能使溴的四氯化碳溶液褪色
II.能与NaHCO3溶液发生反应.
【答案】
(1)CH3CH2OH ![]() CH2=CH2↑+H2O
CH2=CH2↑+H2O
(2)![]()
(3)取代反应;![]()
(4)(CH3)2C=CHCOOH
【解析】解:(1)甲是乙烯,利用乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯,乙醇发生了消去反应,反应方程式为:CH3CH2OH ![]() CH2=CH2↑+H2O,
CH2=CH2↑+H2O,
所以答案是:CH3CH2OH ![]() CH2=CH2↑+H2O;(2)苯与液溴发生取代反应生成溴苯,该反应为
CH2=CH2↑+H2O;(2)苯与液溴发生取代反应生成溴苯,该反应为 ![]() ,
,
所以答案是: ![]() ;(3)C与D反应能生成相对分子质量为100的酯E,为酯化反应,属于取代反应,该反应为
;(3)C与D反应能生成相对分子质量为100的酯E,为酯化反应,属于取代反应,该反应为 ![]() ,所以答案是:取代反应;
,所以答案是:取代反应; ![]() ;(4)满足下列条件的E的同分异构体结构简式:I.分子中存在两个相同甲基并能使溴的四氯化碳溶液褪色,说明含有不饱和键,
;(4)满足下列条件的E的同分异构体结构简式:I.分子中存在两个相同甲基并能使溴的四氯化碳溶液褪色,说明含有不饱和键,
II.能与NaHCO3溶液发生反应,则含﹣COOH,所以符合条件的同分异构体的结构简式为:(CH3)2C=CHCOOH,所以答案是:(CH3)2C=CHCOOH.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】从能量的角度看,断开化学键要 , 形成化学键要 . 已知拆开1mol H﹣H键、1mol I﹣I、1mol H﹣I键分别需要吸收的能量为436kJ、151k J、299k J.则由氢气和碘反应生成1mol HI需要(填“放出”或“吸收”) k J的热量.当反应物的总能量高于生成物总能量时,该反应为反应;当反应物的总能量低于生成物总能量时,该反应为反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据化学反应的实质是旧键断裂和新键形成这一观点,下列变化属于旧键断裂但没有发生化学反应的是( )
A. 氯化钠受热熔化B. 石墨在高温高压下转化为金刚石
C. 单质碘受热升华D. 固态S8加热到444.6℃时变成硫蒸气S2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知苯甲酸微溶于水,易溶于乙醇、乙醚,有弱酸性,酸性比醋酸强.它可用于制备苯甲酸乙酯和苯甲酸铜. (一)制备苯甲酸乙酯![]() +C2H5OH
+C2H5OH ![]()
![]() +H2O
+H2O
相关物质的部分物理性质如上表格:
催化剂组分质量分数(%) | CuO | 0 | 25 | 50 | 75 | 100 |
ZnO | 100 | 75 | 50 | 25 | 0 | |
达到平衡所需要时间(h) | 2.5 | 7.4 | 8.1 | 12 | 无催化剂 | |
实验流程如下:
(1)制备苯甲酸乙酯,下列装置最合适的是 , 反应液中的环己烷在本实验中的作用 . 
(2)步骤②控制温度在65~70℃缓慢加热液体回流,分水器中逐渐出现上、下两层液体,直到反应完成,停止加热.放出分水器中的下层液体后,继续加热,蒸出多余的乙醇和环己烷.反应完成的标志是 .
(3)步骤③碳酸钠的作用是 , 碳酸钠固体需搅拌下分批加入的原因 .
(4)步骤④将中和后的液体转入分液漏斗分出有机层,水层用25mL乙醚萃取,然后合并至有机层,用无水MgSO4干燥.乙醚的作用 .
(5)步骤⑤蒸馏操作中,下列装置最好的是(填标号),蒸馏时先低温蒸出乙醚,蒸馏乙醚时最好采用(水浴加热、直接加热、油浴加热). 
(6)(二)制备苯甲酸铜 将苯甲酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2粉未,然后水浴加热,于70~80℃下保温2~3小时;趁热过滤,滤液蒸发冷却,析出苯甲酸铜晶体,过滤、洗涤、干燥得到成品.
混合溶剂中乙醇的作用是 , 趁热过滤的原因
(7)本实验中下列药品不能代替氢氧化铜使用的是
A.醋酸铜
B.氧化铜
C.碱式碳酸铜
D.硫酸铜
(8)洗涤苯甲酸铜晶体时,下列洗涤剂最合适的是
A.冷水
B.热水
C.乙醇
D.乙醇水混合溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同位素示踪法可用于反应机理的研究,下列反应或转化中同位素示踪表示正确的是( )
A.2Na218O2+2H2O═4Nal8OH+O2↑
B.NH4Cl+2H2O═NH32H2O+HCl
C.2KMnO4+5H218O2+3H2SO4═K2SO4+2MnSO4+518O2↑+8H2O
D.K37ClO3+6HCl═K37Cl+3Cl2↑+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,pH=1的某溶液A中含有NH4+、K+、Na+、Fe3+、Al3+、Fe2+、CO32﹣、NO3﹣、Cl﹣、I﹣、SO42﹣中的4种,且各离子的物质的量浓度均为0.1mol/L,现取该溶液进行有关实验,实验结果如图所示:下列有关说法正确的是( ) 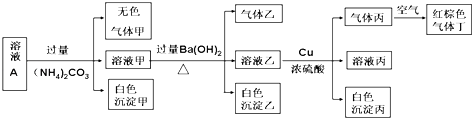
A.沉淀乙一定有BaCO3 , 可能有BaSO4
B.实验消耗Cu 14.4g,则生成气体丁的体积为3.36L
C.该溶液中一定有NO3﹣、Al3+、SO42﹣、Cl﹣四种离子
D.生成的甲、乙、丙气体均为无色的易溶于水气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各电离方程式中,书写正确的是( )
A.CH3COOHH++CH3COO﹣
B.KHSO4K++H++SO42﹣
C.Al(OH)3Al3++3OH﹣
D.NaH2PO4Na++H2PO42﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com