
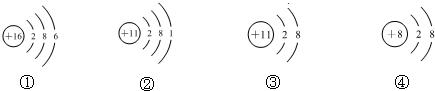
| A. | 它们表示四种元素 | |
| B. | ②③的化学性质相同 | |
| C. | ②表示的元素是金属元素 | |
| D. | ①表示的是原子,而④表示的是阴离子 |
分析 先分析结构示意图得到①是氧原子,②是镁离子,③是镁原子,④是氟离子,再分别判断各选项即可.
解答 解:①圆内是8,圆外的电子总数 8,所以该图是氧原子的结构示意图;
②圆内是12,圆外的电子总数10,所以该图是镁离子的结构示意图;
③圆内是12,圆外的电子总数12,所以该图是镁原子的结构示意图;
④圆内是9,圆外的电子总数10,所以该图是氟离子的结构示意图.
A.由上述分析可知,①是氧原子,②是镁离子,③是镁原子,④是氟离子,所以是氧元素、镁元素和氟元素,三种,故A错误;
B.②是镁离子,③是镁原子,最外层电子不同,所以②③的化学性质不相同,故B错误;
C.镁是金属,故C正确;
D.①是氧原子,④是氟离子,故D正确.
故选AB.
点评 主要考查了元素的概念,原子和离子的区别和联系,粒子结构示意图.会读懂原子结构示意图,还要知道电子层的最外层是8个电子(H是2个电子)时为稳定结构,最外层电子数小于4时易失去电子使次外层变为最外层为8电子稳定结构,大于4时易得到电子使最外层为8电子稳定结构.具有相同核电荷数(即质子数)的同一类原子总称为元素.在这里,离子是带电荷的原子或原子团,难度不大.


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.4 mol | B. | 0.5 mol | C. | 0.6 mol | D. | 0.8 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 2015年我国药物化学家屠吆吆因发明抗疟疾新药青蒿素和双氢青蒿素被授予诺贝尔生理学或医学奖.以异胡薄荷醇为起始原料是人工合成青蒿素的途径之一(如图).下列说法正确的是( )
2015年我国药物化学家屠吆吆因发明抗疟疾新药青蒿素和双氢青蒿素被授予诺贝尔生理学或医学奖.以异胡薄荷醇为起始原料是人工合成青蒿素的途径之一(如图).下列说法正确的是( )| A. | 异胡薄荷醇遇FeCl3溶液显紫色 | |
| B. | 异胡薄荷醇可发生消去反应、加成反应 | |
| C. | 青蒿素分子中含有7个手性碳原子 | |
| D. | 青蒿素在热的酸、碱溶液中均可稳定存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烯烃各同系物中碳的质量分数相等 | |
| B. | C2H4和C4H8一定是同系物 | |
| C. | 分子量相同的两种物质不一定是同分异构体 | |
| D. | C2H6和C4H10一定是同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PM2.5是指直径为2.5pm颗粒物 | |
| B. | PM2.5造成的雾霾天气,空气质量很差,对人体健康危害极大 | |
| C. | 空气中的PM2.5,表示每立方米空气中直径小于或等于2.5um的颗粒物的含量,则PM2.5可能导致空气形成气溶胶 | |
| D. | 无风雾霾中的PM2.5的运动应属于布朗运动 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
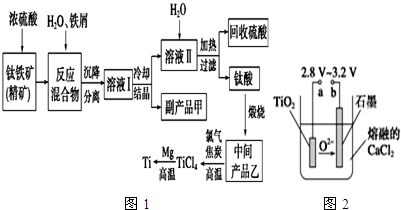
| 氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
| Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜与稀盐酸反应:Cu+2H +═Cu2 ++H2↑ | |
| B. | 小苏打与氢氧化钠溶液混 合:HCO3 -+OH -═CO2↑+H2 O | |
| C. | 氯化钙与碳酸氢钾溶液混合:Ca2 ++CO3 2 -═CaCO3↓ | |
| D. | CuSO4 与Ba(OH)2 溶液混合Cu2 ++SO4 2 -+2OH -+Ba2+═BaSO4↓+Cu(OH)2↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com