
【题目】根据元素周期表回答下列问题:
(1)写出元素Cu的基态原子的电子排布式:____________________。
(2)某元素A的核外价电子排布式为nsnnpn+1,该元素A原子核外最外层电子中成对电子共有________对。此元素A原子与O的第一电离能的相对大小为:A________ O(填“<”“>”或“=”)。
(3)元素C形成的最高价氧化物中含有________个π键。C和Cl形成化合物的电子式为_____________,此化合物中C的杂化方式为________。
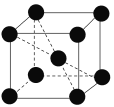
(4)已知元素钒形成单质的晶胞如下图所示,则其原子的配位数是________,假设晶胞的边长为d cm、密度为ρ g·cm-3,则元素钒的相对原子质量为_____________ (NA为阿伏加德罗常数)。
【答案】[Ar]3d104s1或1s22s22p63s23p63d104s1 1 > 2 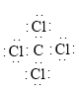 sp3 8
sp3 8 ![]()
【解析】
(1)Cu元素为29号元素,原子核外有29个电子;
(2)元素A的原子外围电子排布式为nSnnPn+1,s能级容纳2个电子,则n=2,故A原子外围电子排布式为2S22P3,则A为N元素;
(3)二氧化碳的结构式为O=C=O,分子中含有2个碳氧双键,四氯化碳为共价化合物,空间构型为正四面体;
(4)根据晶胞图可知,每个矾原子周围距离最近的有8个矾原子,每个晶胞中含有的矾原子数为2,根据ρ= 2M/NAV可计算出钒的相对原子质量。
(1)Cu元素为29号元素,原子核外有29个电子,所以核外电子排布式为:[Ar]3d104s1或1s22s22p63s23p63d104s1,故答案为:[Ar]3d104s1或1s22s22p63s23p63d10
4s1;
(2)元素A的原子外围电子排布式为nSnnPn+1,s能级容纳2个电子,则n=2,故A原子外围电子排布式为2S22P3,则A为N元素,N原子最外层电子中有1个成对电子,3个未成对电子;同周期自左而右第一电离能呈增大趋势,但N元素2p能级容纳3个电子,处于半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能N>O,故答案为:1;>;
(3)二氧化碳的结构式为O=C=O,分子中含有2个碳氧双键,含有2个π键,四氯化碳为共价化合物,电子式为 ,四氯化碳的空间构型为正四面体形,C原子的杂化方式为sp3杂化,故答案为:2;
,四氯化碳的空间构型为正四面体形,C原子的杂化方式为sp3杂化,故答案为:2; ;sp3;
;sp3;
(4)根据晶胞图可知,每个矾原子周围距离最近的有8个矾原子,所以矾的配位数为8,每个晶胞中含有的矾原子数为1+8×1/8=2,晶胞的体积为d3cm3,根据ρ= 2M/NAV可知,钒的相对原子质量M=ρd3NA/2,故答案为:8;ρd3NA/2。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】2016年IUPAC命名117号元素为TS(中文名![]() ,tián),TS的原子核外最外层电子数是7.下列说法不正确的是( )
,tián),TS的原子核外最外层电子数是7.下列说法不正确的是( )
A. TS是第七周期第ⅦA族元素 B. TS的同位素原子具有相同的电子数
C. TS在同族元素中非金属性最弱 D. 中子数为176的TS核素符号是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大。试回答下列问题:
(1)已知:高炉炼铁过程中会发生如下反应:
①FeO(s)+CO(g)===Fe(s)+CO2(g) ΔH1
②3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) ΔH2
③Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH3
则反应Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g)的ΔH的表达式为_______________________________(用含ΔH1、ΔH2、ΔH3的代数式表示)。
(2)上述反应在高炉中大致分为三个阶段,各阶段主要成分与温度的关系如下表:
温度/℃ | 250 | 600 | 1000 | 2000 |
主要成分 | Fe2O3 | Fe3O4 | FeO | Fe |
1600 ℃时固体物质的主要成分为_____________(填化学式);若该温度下,测得固体混合物中m(Fe)∶m(O)=35∶4,则FeO被CO还原为Fe的百分率为______________(设其他固体杂质中不含Fe、O元素)。
(3)铁的某些化合物可用作CO与H2反应的催化剂。已知某种铁的化合物可用来催化反应:CO(g) + 3H2(g)![]() CH4(g) + H2O(g) ΔH <0 。
CH4(g) + H2O(g) ΔH <0 。
在T ℃、a MPa时,将2 mol CO和6 mol H2充入某容积可变的密闭容器中,实验测得CO的物质的量在反应体系中所占百分比x(CO)如下表:
t/min | 0 | 10 | 20 | 30 | 40 | 50 |
x(CO) | 0.25 | 0.23 | 0.21 | 0.20 | 0.10 | 0.10 |
① T ℃ a MPa时,此反应的平衡常数K = ____________(保留1位小数)。达到平衡时CO的转化率为___________。

②上图表示该反应CO的平衡转化率与温度、压强的关系。
图中温度T1、T2、T3由低到高的顺序是________________。图中显示其它条件固定时,增加压强会导致平衡向___________(填“左”或“右”)移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表标出的是元素周期表的一部分元素,回答下列问题:
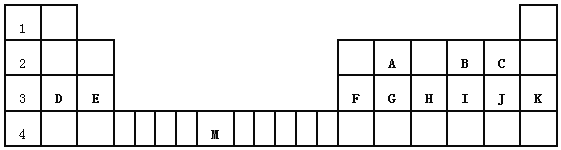
(1)除稀有气体外第三周期中原子半径最小的是_____(填元素符号)
(2)表中用字母标出的12种元素中,化学性质最不活泼的是_____(用元素符号表示,下同),金属性最强的是___(用元素符号表示),属于过渡元素的是___(该空格用表中的字母表示)
(3)元素B的单质含有的化学键为_____。(填“离子键’’、“极性共价键”、“非极性共价键”)
(4)D、F元素最高价氧化物对应水化物相互反应的离子方程式为_____________
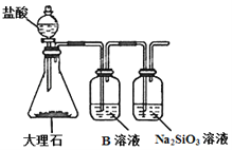
(5)为比较元素A和G的非金属性强弱,用图所示装置进行实验(夹持仪器已略去,装置气密性良好)。溶液B应该选用_____溶液,作用是_________,能说明A和G非金属性强弱的化学方程式是:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含氧有机化合物可以作为无铅汽油的抗爆震剂,其相对分子质量为88.0,含C的质量分数为0.682,含H的质量分数为0.136。
(1)试确定该化合物的分子式___。
(2)经红外光谱和核磁共振氢谱显示该分子中有4个甲基。请写出其结构简式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C,H,N三种化学元素在组成人体的化学成分中,质量分数共占73%左右,而在组成岩石圈的化学成分中,质量分数还不到1%,这一事实说明了( )
A. 生物界与非生物界没有区别
B. 生物界与非生物界的元素组成是不同的
C. 生物界与非生物界具有差异性
D. 生物界与非生物界具有统一性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去混在白糖中的少量泥沙,需采取的正确操作是( )
A. 溶解、过滤、蒸发 B. 溶解、加热、结晶
C. 溶解、蒸发、振荡 D. 搅拌、溶解、称量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com