
【题目】对于下列氧化还原反应,请按要求填空。
Cu + 4HNO3(浓)=== Cu(NO3)2+ 2NO2↑ + 2H2O
①用双线桥法标出电子转移的方向和数目_____________;
②氧化剂________,氧化产物__________;
③被还原的HNO3与参加反应的HNO3物质的量之比是_______;若有1molCu被氧化,则被还原的硝酸质量为 _____ g;若参加反应的硝酸为1.6mol,则放出气体的体积(在标准状况下)为___L;
④离子方程式:_______。
【答案】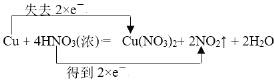 HNO3 Cu(NO3)2 1:2 126 17.92 Cu+4H++2NO3- = Cu2++2NO2↑+2H2O;
HNO3 Cu(NO3)2 1:2 126 17.92 Cu+4H++2NO3- = Cu2++2NO2↑+2H2O;
【解析】
根据铜元素的化合价升高,硝酸中氮元素的化合价降低,来画双线桥,根据氧化还原反应的概念分析氧化剂和氧化产物,利用化合价降低来分析被还原的物质的物质的量,根据方程式进行计算。
①铜元素的化合价升高,硝酸中氮元素的化合价降低,双线桥法标出电子转移的方向和数目 ;故答案为:
;故答案为:
②所含元素的化合价降低的物质是氧化剂,硝酸中氮元素的化合价降低,因此氧化剂为HNO3;化合价升高得到的产物为氧化产物,Cu元素的化合价升高后得到Cu(NO3)2,因此氧化产物是Cu(NO3)2;故答案为;HNO3;Cu(NO3)2。
③4mol硝酸参与反应,其中有2mol硝酸被还原,因此被还原的HNO3与参加反应的HNO3物质的量之比是2:4 = 1:2;若有1molCu被氧化,则被还原的硝酸物质的量为2mol,被还原的硝酸质量为2 mol ×63 gmol1=126 g;根据化学方程式4mol硝酸反应生成2mol气体,若参加反应的硝酸为1.6mol,则生成的气体物质的量为![]() ,放出气体的体积(在标准状况下)为0.8mol ×22.4 L·mol1= 17.92L;故答案为:1:2;126;17.92。
,放出气体的体积(在标准状况下)为0.8mol ×22.4 L·mol1= 17.92L;故答案为:1:2;126;17.92。
④硝酸是强酸,硝酸铜是易溶于水的盐,因此该反应的离子方程式为Cu+4H++2NO3- = Cu2++2NO2↑+2H2O;故答案为:Cu+4H++2NO3- = Cu2++ 2NO2↑+ 2H2O。


科目:高中化学 来源: 题型:
【题目】O2和O3是氧元素的两种单质,根据其分子式完成下列各题:
(1)等温等压下,等质量的O2和O3所含分子个数比为________,原子个数比为________,体积之比为________。
(2)设NA为阿伏加德罗常数的数值,如果a g氧气中含有的分子数为b,则c g氧气在标准状况下的体积约是________(用含NA的式子表示)。
(3)配制500 mL 1 mol/L的稀H2SO4溶液,需要用量筒量取浓H2SO4(密度为1.84 g/mL,质量分数为98%)的体积为________ mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组按如下实验过程证明了海带中存在的碘元素:
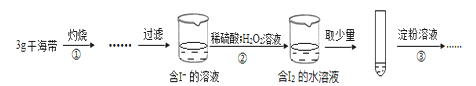
下列说法不正确的是
A.步骤①需要将干海带放入坩埚中灼烧
B.步骤②反应的离子方程式为:2I- +2H++H2O2=I2+2H2O
C.步骤③操作后,观察到试管中溶液变为蓝色,可以说明海带中含有碘元素
D.若步骤②仅滴加稀硫酸后放置一会儿,步骤③操作后,试管中溶液不变成蓝色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程,请回答下列问题:
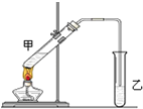
(1)浓硫酸的作用是:①__________②______________;
(2)饱和碳酸钠溶液的主要作用是________________;
(3)装置中通蒸气的导管只能插到饱和碳酸钠溶液的液面处,不能插入溶液中,目的____,长导管的作用是____;
(4)若要把制得的乙酸乙酯分离出来,应采用的实验操作是____;
(5)进行该实验时,最好向试管甲中加入几块碎瓷片,其目的是____;
(6)实验室可用乙醇来制取乙烯,将生成的乙烯通入溴的四氯化碳溶液,反应后生成物的结构简式是____;
(7)生成乙酸乙酯的反应是可逆反应,反应物不能完全转化为生成物,反应一段时间后,就达到了该反应的限度,即达到化学平衡状态,下列描述能说明该反应已达到化学平衡状态的是(填序号)____。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A是合成二氢荆芥内酯的重要原料,其结构简式如下图,下列检验A中官能团的试剂和顺序正确的是( )
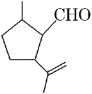
A. 先加酸性高锰酸钾溶液,后加银氨溶液,微热
B. 先加溴水,后加酸性高锰酸钾溶液
C. 先加银氨溶液,微热,再加入溴水
D. 先加入新制氢氧化铜,微热,酸化后再加溴水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对有机物结构或性质的描述,错误的是( )
A. 一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应
B. 苯酚钠溶液中通入少量CO2,可以生成苯酚和碳酸钠
C. 乙烷和丙烯的物质的量共1 mol,完全燃烧生成3 mol H2O
D. 光照下2,2─二甲基丙烷与Br2反应,其一溴取代物只有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:2FeSO4 + 6 Na2O2 = 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑,该反应中还原剂是___________________(填化学式),被2 mol FeSO4还原的过氧化钠为_________mol
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。写出碱性条件下制高铁酸钾的离子反应方程式:__________________________
Ⅱ.已知:2Fe3++2I-=2Fe2++I2,2Fe2++Br2=2Fe3++2Br-。
(1)含有1 mol FeI2和2 mol FeBr2的溶液中通入2 mol Cl2,此时被氧化的离子是____________,被氧化的离子的物质的量分别是_____________________________________________
(2)若向含a mol FeI2和b mol FeBr2的溶液中通入c mol Cl2,当I-、Fe2+被氧化时,c为_____________(用含a、b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是研究铁被海水腐蚀的实验装置。图2中M是某种与铁片紧贴的金属,下列说法正确的是

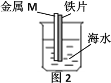
A.图1铁片靠近烧杯底部的部分,腐蚀更严重
B.若M是锌片,可保护铁
C.若M是铜片,可保护铁
D.M是铜或是锌都不能保护铁,是因没有构成原电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将铁钉放入纯水中,一段时间后,铁钉表面有铁锈生成,下列说法正确的是
![]()
A.铁钉与水面交接处最易腐蚀
B.铁钉发生吸氧腐蚀,铁做阴极
C.铁发生的反应是:Fe-3e→Fe3+
D.水上和水下部分的铁钉不发生电化腐蚀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com