
【题目】由B、N及Mg、Ni等元素组成的新型材料有着广泛的用途,回答下列向题:
(1)Ni2+元素基态原子的电子排布式为____________。
(2)经测定发现,N2O5固体由NO2+和NO3-同种离子组成,该固体中N原子杂化类型为_____;与NO2+互为等电子体的微粒有______(写出一种)。
(3)铵盐大多不稳定。NH4F、NH4I中,较易分解的是______,原因是____________。
(4)第二周期中,第一电离能介于B元素和N元素间的元素为_______(填元素符号)
(5)已知NiO的晶体结构如图所示。
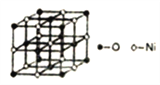
①NiO的晶体结构可描述为:氧原子位于面心和顶点,氧原子可形成正八面体空隙和正四面体空隙,镍原子填充在氧原子形成的空隙中。则NiO晶体中镍原子填充在氧原子形成的____体空隙中。
②已知MgO与NiO的晶体结构相同,其中Mg2+和Ni2+的离子半径分别为66pm和69pm,则熔点MgO______NiO(填“>”、“<”或“=”),理由是___________。
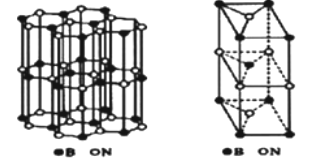
(6)硼和氮构成的一种氮化硼晶体的结构与石墨晶体结构相类似B、N原子相互交替排列如图左下图,其晶胞结构如右下图所示。设层内B-N核间距为apm,面间距为bpm,则该氮化硼晶体的密度为_______g/cm3(用含a、b、NA的代数式表示)。
【答案】 1s22s22p63s23p63d8或[Ar] 3d8 sp、sp2 SCN-、CO2、CS2、N3- 等中的任一种 NH4F F原子半径比I原子小,H→F键比H→I键强(H→F更易形成),F-更易夺取NH4+中的H+ Be、C、O 正八面 > Mg2+半径比Ni2+小, MgO 的晶格能比NiO 大 
【解析】试题分析:(1)Ni2+核外有26个电子,根据能量最低原理书写电子排布式;(2) NO2+中N原子价电子对数是![]() 、NO3-中N原子价电子对数是
、NO3-中N原子价电子对数是![]() ,根据N原子的价电子对数判断N原子杂化类型;等电子体是原子数相同、价电子数也相同的微粒;(3) F原子半径比I原子小,H→F键比H→I键强;(4)同周期元素从左到右,第一电离能逐渐增大,由于ⅡA元素的S轨道全充满,第一电离能大于ⅢA元素,ⅤA族元素P轨道半充满,第一电离能大于ⅥA的元素; (5) ①根据晶胞结构,镍原子前后、左右、上下各有1个氧原子;②离子半径越小,晶格能越大;(6)根据晶胞结构图,每个原子被6个六棱柱共用;利用均摊原则计算1个六棱柱中占用的原子数,根据
,根据N原子的价电子对数判断N原子杂化类型;等电子体是原子数相同、价电子数也相同的微粒;(3) F原子半径比I原子小,H→F键比H→I键强;(4)同周期元素从左到右,第一电离能逐渐增大,由于ⅡA元素的S轨道全充满,第一电离能大于ⅢA元素,ⅤA族元素P轨道半充满,第一电离能大于ⅥA的元素; (5) ①根据晶胞结构,镍原子前后、左右、上下各有1个氧原子;②离子半径越小,晶格能越大;(6)根据晶胞结构图,每个原子被6个六棱柱共用;利用均摊原则计算1个六棱柱中占用的原子数,根据![]() 计算密度。
计算密度。
解析:(1)Ni2+核外有26个电子,根据能量最低原理,电子排布式为1s22s22p63s23p63d8;(2) NO2+中N原子价电子对数是![]() ,N原子杂化类型是SP 、NO3-中N原子价电子对数是
,N原子杂化类型是SP 、NO3-中N原子价电子对数是![]() ,N原子杂化类型是sp2;等电子体是原子数相同、价电子数也相同的微粒,所以NO2+的等电子体是SCN-、CO2、CS2、N3- 等;(3) F原子半径比I原子小,H→F键比H→I键强,F-更易夺取NH4+中的H+,所以NH4F更易分解;(4)同周期元素从左到右,第一电离能逐渐增大,由于ⅡA元素的S轨道全充满,第一电离能大于ⅢA元素,ⅤA族元素P轨道半充满,第一电离能大于ⅥA的元素;所以第二周期中,第一电离能介于B元素和N元素间的元素为Be、C、O;(5) ①根据晶胞结构,镍原子前后、左右、上下各有1个氧原子,NiO晶体中镍原子填充在氧原子形成的正八面体空隙中;②离子半径越小,晶格能越大、熔点越高,Mg2+半径比Ni2+小, MgO 的晶格能比NiO 大,所以熔点MgO>NiO;(6)根据晶胞结构图,每个原子被6个六棱柱共用;根据均摊原则1个六棱柱中占用的B原子数是
,N原子杂化类型是sp2;等电子体是原子数相同、价电子数也相同的微粒,所以NO2+的等电子体是SCN-、CO2、CS2、N3- 等;(3) F原子半径比I原子小,H→F键比H→I键强,F-更易夺取NH4+中的H+,所以NH4F更易分解;(4)同周期元素从左到右,第一电离能逐渐增大,由于ⅡA元素的S轨道全充满,第一电离能大于ⅢA元素,ⅤA族元素P轨道半充满,第一电离能大于ⅥA的元素;所以第二周期中,第一电离能介于B元素和N元素间的元素为Be、C、O;(5) ①根据晶胞结构,镍原子前后、左右、上下各有1个氧原子,NiO晶体中镍原子填充在氧原子形成的正八面体空隙中;②离子半径越小,晶格能越大、熔点越高,Mg2+半径比Ni2+小, MgO 的晶格能比NiO 大,所以熔点MgO>NiO;(6)根据晶胞结构图,每个原子被6个六棱柱共用;根据均摊原则1个六棱柱中占用的B原子数是![]() 、N原子数是
、N原子数是![]() ,晶胞的摩尔质量是(11+14)g/mol,晶胞的体积是
,晶胞的摩尔质量是(11+14)g/mol,晶胞的体积是![]() ,所以
,所以![]() g/cm3。
g/cm3。


科目:高中化学 来源: 题型:
【题目】工业上利用硫铁矿烧渣(主要成分为Fe3O4、Fe2O3、FeO、SiO2)为原料制备高档颜料——铁红(Fe2O3),具体生产流程如下:
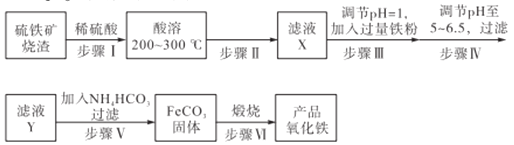
试回答下列问题:
(1)实验室实现“步骤II”中分离操作所用的玻璃仪器有____、玻璃棒和烧杯等;该步骤是为了除去_______(填相关物质的化学式)。
(2)检验步骤III已经进行完全的操作是_______________________。
(3)步骤V的反应温度一般需控制在35℃以下,其目的是______________;该步骤中反应生成FeCO3的离子反应方程式为___________。
(4)步骤VI中发生反应的化学反应方程式为____________________。
(5)步骤V中,FeCO3达到沉淀溶解平衡时,若c(Fe2+)=1×10-6mol/L,欲使所得的FeCO3中不含有Fe(OH)2,应控制溶液的pH≤_____(已知:Ksp[Fe(OH)2]=4.9×10-17,lg7=0.8)。
(6)欲测定硫铁矿矿渣中Fe元素的质量分数,称取ag样品,充分“酸溶” “水溶”后过滤,向滤液中加入足量的H2O2,充分反应后加入NaOH溶液至不再继续产生沉淀,经过滤、洗涤、灼烧至固体恒重,冷却后称得残留固体bg,测得该样品中Fe元素的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对分别盛有不同无色溶液①②③④四支试管进行如下操作。现象和结论对应正确的是
操作 | 现象 | 结论 | |
A | 向①中滴加NaOH溶液,加热,将湿润红色石蕊试纸置于试管口 | 试纸变蓝 | 原溶液中有NH4+ |
B | 向②中滴入NaHCO3溶液 | 有白色沉淀生成 | 原溶液中有AlO2- |
C | 向③中先滴加BaCl2溶液再滴加HCl溶液 | 生成白色沉淀 | 原溶液中有SO42- |
D | 向④中滴加氯水和CCl4,振荡静置 | 下层溶液呈橙色 | 原溶液中有I- |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为0.1mol/L体积均为Vo的HX、HY溶液,分别加水稀释至体积V,pH随V的变化关系如下图所示。下列叙述不正确的是

A. HX的酸性比HY的弱,且HY是强酸
B. NaX溶液中存在关系:c(X-)+c(HX)=c(Na+)
C. 相同温度下,电离常数K(HX):a=b
D. ![]() ,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),则
,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),则![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于纯净物、混合物、强电解质、弱电解质和非电解质的组合正确的是
组合 | 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 |
A | 氨水 | 食盐水 | 硫酸 | 醋酸 | 干冰 |
B | 氧化铁 | 家用食醋 | 硫酸钡 | 碳酸 | 蔗糖 |
C | 胆矾 | 碘酒 | 苛性钠 | 碳酸 | 碳酸钙 |
D | 盐酸 | 氯化钾溶液 | 氯化钠 | 氢氧化铜 | 氢气 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是原子序数依次增大的第二、三周期主族元素,A、B、C的单质(用a、b、c表示)与化合物x、y、z有如图所示的转化关系,B与D同主族。下列说法正确的是

A. 化合物y阴阳离子个数比为1:1
B. 简单离子半径:D>C>B
C. 最高价氧化物对应的水化物的酸性:A>D
D. A与D形成的化合物AD2中各原子均满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用图所示实验装置(夹持仪器己略去)探究铜丝与过量浓硫酸的反应.下列实验不合理的是( )

A. 上下移动①中铜丝可控制SO2的产生与停止
B. ②中选用品红溶液验证SO2的生成
C. ③中选用NaOH溶液吸收多余的SO2
D. 为确认有CuSO4生成,向①中加水,观察颜色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com