

| 112 |
| 160 |
| 112(W2-W1) |
| 160a |
| 112(W2-W1) |
| 160a |


科目:高中化学 来源: 题型:
| c(CH3COO-) |
| c(H+) |
| c(CH3COO-) |
| c(CH3COOH)?c(OH-) |
| 溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定是共价键 |
| B、一定是离子键 |
| C、可能是共价键,也可能是离子键 |
| D、一定是极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
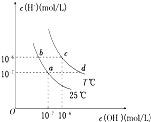
| A、a点对应的溶液中大量存在:Fe3+、Na+、Cl-、SO42- |
| B、b点对应的溶液中大量存在:NH4+、Ba2+、ClO-、I- |
| C、c点对应的溶液中大量存在:Na+、Ba2+、Cl-、CO32- |
| D、d点对应的溶液中大量存在:Na+、K+、SO32-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 前四周期元素A、B、C、D、E原子序数依次增大,A是周期表所有原子中原子半径最小的,B有三个能级,且各个能级上电子数相等,D与C同周期,且C中未成对电子是该周期中最多的;D基态原子的2p电子是2s电子的2倍;E有4个电子层,且与A最外层电子数相同,其他各层均排满.
前四周期元素A、B、C、D、E原子序数依次增大,A是周期表所有原子中原子半径最小的,B有三个能级,且各个能级上电子数相等,D与C同周期,且C中未成对电子是该周期中最多的;D基态原子的2p电子是2s电子的2倍;E有4个电子层,且与A最外层电子数相同,其他各层均排满.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com