
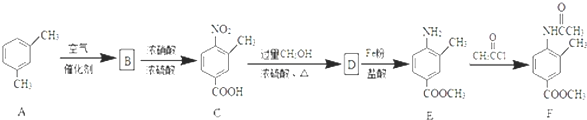
 ;由D→E的反应类型是还原反应.
;由D→E的反应类型是还原反应. .
. .
.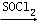 RCOCl.请写出以CH3CH2OH、
RCOCl.请写出以CH3CH2OH、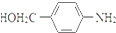 为原料,制备化合物
为原料,制备化合物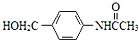 的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:H2C═CH2
的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:H2C═CH2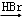 CH3CH2Br
CH3CH2Br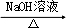 CH3CH2OH.
CH3CH2OH. 分析 根据题中各物质转化关系,比较A和C的结构可知,间二甲苯在催化剂的条件下被空气氧化得B为 ,B发生硝化反应生成C,C发生酯化反应生成D为
,B发生硝化反应生成C,C发生酯化反应生成D为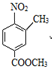 ,D被铁粉还原得E,E发生取代反应生成F,
,D被铁粉还原得E,E发生取代反应生成F,
(1)根据C的结构简式可知所含有含氧官能团;
(2)根据上面分析可知B的结构和反应类型;
(3)C发生酯化反应生成D;
(4)根据条件Ⅰ.能发生银镜反应,说明有醛基;Ⅱ.水解产物之一遇FeCl3溶液显色,水解产物有酚羟基;Ⅲ.分子中含有4种不同化学环境的氢,结合E的结构书写同分异构体;
(5)以CH3CH2OH、 为原料,制备化合物
为原料,制备化合物 ,可以将乙醇氧化得乙醛,乙醛氧化得乙酸,乙酸与SOCl2反应生成CH3COCl,用CH3COCl与
,可以将乙醇氧化得乙醛,乙醛氧化得乙酸,乙酸与SOCl2反应生成CH3COCl,用CH3COCl与 反应即可得产品,据此答题.
反应即可得产品,据此答题.
解答 解:根据题中各物质转化关系,比较A和C的结构可知,间二甲苯在催化剂的条件下被空气氧化得B为 ,B发生硝化反应生成C,C发生酯化反应生成D为
,B发生硝化反应生成C,C发生酯化反应生成D为 ,D被铁粉还原得E,E发生取代反应生成F,
,D被铁粉还原得E,E发生取代反应生成F,
(1)根据C的结构简式可知所含有含氧官能团为羟基和硝基,故答案为:羧基;硝基;
(2)根据上面分析可知B的结构为 ,D→E的反应类型为还原反应,
,D→E的反应类型为还原反应,
故答案为: ;还原反应;
;还原反应;
(3)C发生酯化反应生成D,反应方程式为 ,
,
故答案为: ;
;
(4)根据条件Ⅰ.能发生银镜反应,说明有醛基;Ⅱ.水解产物之一遇FeCl3溶液显色,水解产物有酚羟基;Ⅲ.分子中含有4种不同化学环境的氢,结合E的结构书可知,其同分异构体为 ,
,
故答案为: ;
;
(5)以CH3CH2OH、 为原料,制备化合物
为原料,制备化合物 ,可以将乙醇氧化得乙醛,乙醛氧化得乙酸,乙酸与SOCl2反应生成CH3COCl,用CH3COCl与
,可以将乙醇氧化得乙醛,乙醛氧化得乙酸,乙酸与SOCl2反应生成CH3COCl,用CH3COCl与 反应即可得产品,合成路线为
反应即可得产品,合成路线为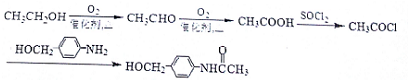 ,
,
故答案为: .
.
点评 本题考查有机物推断,侧重考查分析、推断能力,涉及常见官能团之间的转化,根据已知物质结构结合反应条件采用正逆结合的方法进行推断,熟练掌握常见有机物的结构和性质,题目难度不大,注意应用题中信息.


科目:高中化学 来源: 题型:选择题
| A. | 14C可用于测定一些文物的年代,该过程是化学变化 | |
| B. | 烧结粘土制陶瓷是物理变化 | |
| C. | 服用阿司匹林出现水杨酸反应时,用碳酸氢钠溶液解毒是复分解反应 | |
| D. | 从海水中提取镁的过程中,发生的是非氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
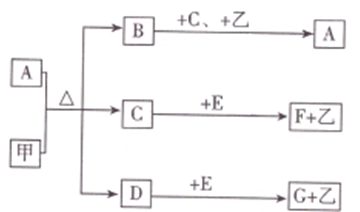
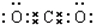 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
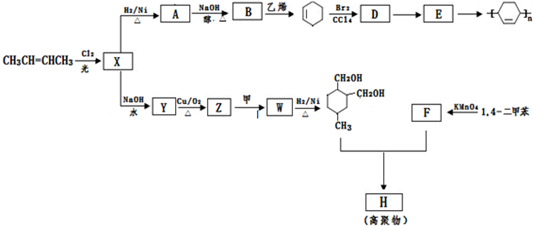
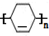
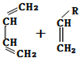 →
→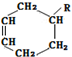 (或写成
(或写成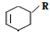 R代表取代基或氢)
R代表取代基或氢)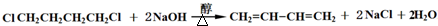 ;
;
 ;
;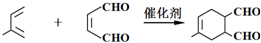 .
.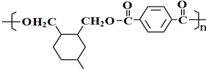 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
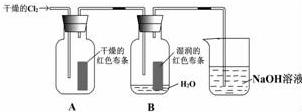 某同学设计了如图的实验:
某同学设计了如图的实验:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
. HSO3-+OH-(用离子方程式表示).
HSO3-+OH-(用离子方程式表示).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Al3+、Cl-、OH-(5:2:4:4) | B. | NH4+、Ba2+、OH-、Cl-(1:1:1:2) | ||
| C. | Fe3+、Na+、Cl-、S2-(1:2:3:1) | D. | K+、H+、I-、NO3-(1:1:1:1) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

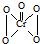 ,该反应
,该反应查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com