
����Ŀ��ij��ȤС����ȡ��������������������ʵ�飬��װ����ͼ��ʾ����ش��������⣺ 
��1������A�������� �� ʵ�����Ʊ������ķ�Ӧ����ʽΪ ��
��2��C�з�����Ӧ�Ļ�ѧ����ʽΪ �� �����������ɫ��������C�У��۲쵽�������� �� ԭ���� ��
��3��ʵ���й۲쵽D��Һ����ɫ�������ϵ�֪���۵⻯����Һ�ǵ��ۺ͵⻯�أ�KI���Ļ����Һ��д��Dװ���з�����Ӧ�����ӷ���ʽ ��
��4��F�����������۷�Ӧ�Ʊ���ˮ���Ȼ�����������֪�û�������غ�ɫ������ˮ���⣬100������ʱ������˫ͨ��F�в�����ά�������뷴Ӧ��������������F��Hװ��֮�䰲װGװ�õ�Ŀ���� ��
��5��H��NaOH��Һ�������� ��
���𰸡�
��1����Һ©���� MnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O
MnCl2+Cl2��+2H2O
��2��Cl2+H2O=HCl+HClO����ɫ������ɫ���������Ƿ�Ӧ�����˴�����,���������ǿ������,�Ӷ�ʹ��ɫ������ɫ
��3��Cl2+2I��=I2+2Cl��
��4����ֹ�Ȼ�����������ĵ��ܣ���ֹH�е�ˮ��������F��,ʹ��ˮ���Ȼ�������
��5�����ն��������,��ֹ������Ⱦ
���������⣺��1������������״��֪����A�������Ƿ�Һ©����ʵ�����ü��ȶ���������Ũ������ȡ���������߷�Ӧ�����Ȼ��̡�������ˮ������ʽ��MnO2+4HCl�� Ũ�� ![]() MnCl2+Cl2��+2H2O��
MnCl2+Cl2��+2H2O��
���Դ��ǣ���Һ©����MnO2+4HCl�� Ũ�� ![]() MnCl2+Cl2��+2H2O����2��������ˮ��Ӧ��������ʹ����ᣬ����ʽ��Cl2+H2O=HCl+HClO�����������ǿ�����ԣ��Ӷ�ʹ��ɫ������ɫ�����������������ɫ��������C�У��۲쵽����������ɫ������ɫ��
MnCl2+Cl2��+2H2O����2��������ˮ��Ӧ��������ʹ����ᣬ����ʽ��Cl2+H2O=HCl+HClO�����������ǿ�����ԣ��Ӷ�ʹ��ɫ������ɫ�����������������ɫ��������C�У��۲쵽����������ɫ������ɫ��
���Դ��ǣ�Cl2+H2O=HCl+HClO����ɫ������ɫ���������Ƿ�Ӧ�����˴����ᣬ���������ǿ�����ԣ��Ӷ�ʹ��ɫ������ɫ����3������������ǿ�ڵⵥ�ʣ�����������ӷ���������ԭ��Ӧ���ɵ�������ӣ����������۱��������ӷ���ʽ��Cl2+2I��=I2+2Cl����
���Դ��ǣ�Cl2+2I��=I2+2Cl������4��˫ͨ��F�в�����ά�������뷴Ӧ���������Ƿ�ֹ�Ȼ�����������ĵ��ܣ��Ȼ�������ˮ���⣬����Ӧ��F��Hװ��֮�䰲װGװ�ã�
���Դ��ǣ���ֹ�Ȼ�����������ĵ��ܣ���ֹH�е�ˮ��������F�У�ʹ��ˮ���Ȼ������⣻��5�������ж�ֱ���ŷ��ܹ�������Ⱦ�������ܹ����������Ʒ�Ӧ��H��NaOH��Һ�����������ն������������ֹ������Ⱦ��
���Դ��ǣ����ն������������ֹ������Ⱦ��
�����㾫�����������⣬������Ҫ�˽�������ʵ�����Ʒ�(ʵ�����Ʒ���MnO2+4HCl��Ũ��=MnCl2+Cl2��+2H2O)��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪԪ�����ڱ�ǰ�����ڵ�һ���֣������й�R��W��X��Y��Z����Ԫ�ص������У���ȷ���ǣ� �� 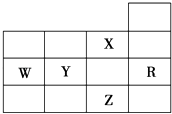
A.WԪ�صĵ�һ������С��YԪ�صĵ�һ������
B.Y��Z�������ӵ��Ӳ�ṹ����Rԭ�ӵ���ͬ
C.p�ܼ�δ�ɶԵ���������ZԪ��
D.XԪ���ǵ縺������Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A�������������������ʵ�����H2�ӳɡ�����A������HCl�ӳɺ����ΪB��B���ı��������ʵ�����Cl2��Ӧ���ܵõ���ȫ±���IJ����A��( )
A.CH2===CH��CH===CH2
B.CH��CH
C.CH3CCH
D.CH2===CH2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������е�����Ԫ�ؿ����γ�ԭ�Ӹ�����Ϊ2��3�Ļ������������Ԫ�ص�ԭ������֮�����Ϊ(����)
A. 1 B. 3 C. 5 D. 6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʵ��װ���У�ʵ�鿪ʼһ��ʱ��Կ�����������������ȷ���ǣ�������
A.
ƻ�����ɱ�
B.
������������С��װߡ�
C.
С�Թ����о�������
D.
pH��ֽ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��Ϊ��ѧ��ѧ�еij��������Ҿ�����ͬһ��Ԫ�أ�����֮���ת����ϵ��ͼ��ʾ����Ӧ���������������Ѿ���ȥ���� A ![]() B
B ![]() C
C ![]() D
D
��1����A��ʹʪ��ĺ�ɫʯ����ֽ������D��ϡ��Һ��ʹ��ɫ��ʯ����ֽ��죬��CΪ���ѧʽ����д��A��B�Ļ�ѧ��Ӧ����ʽ�� ��
��2����B��ʹƷ����Һ��ɫ����D�Ļ�ѧʽΪ �� �����й�B��˵������ȷ����������ţ��� a��ȼ�ջ�ʯȼ�ϲ������B
b����ֽ�����п���BƯ��ֽ��
c����ɫʯ����Һ��B��ˮ��Һ����
d�����������������Ӵ���B��ɱ����
��3����AΪ���ý���Ԫ�صĵ��ʣ�CΪ����ɫ���壬��B�Ļ�ѧʽΪ��д��C��D�����ӷ�Ӧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��Ч�������������ػ�����ȡ��ʩ���ƴ����������о�����Ч���ƿ����еĵ������̼��������������ﺬ���Ե���Ϊ��Ҫ�� 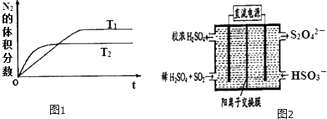
��1��������ȼ������ʱ������N2��O2�ķ�Ӧ��N2+O2�T2NO���ǵ�������β���к���NO��ԭ��֮һ����ѧ���������NH3�ڴ������½�NOx��ԭ��N2���ŷţ�
����T1��T2�¶��£�һ������NH3�����ֽⷴӦʱN2�����������ʱ��仯��ͼ1��ʾ������ͼ���жϷ�ӦN2��g��+3H2��g���T2NH3��g���ġ�H0���������������
����T3�¶��£���2L�ܱ������г���10molN2��5mo1H2 �� 50���ﵽƽ�⣬���NH3�����ʵ���Ϊ2mol����÷�Ӧ������v��N2�� �� ���¶��£�������ѹǿ�˷�Ӧ��ƽ�ⳣ���������������С���������䡱����ȷ������������ʼʱ�����������г���N2��H2��Ϊ10mol����ﵽƽ���H2��ת���ʽ� �� ������ߡ��������͡���
��2������ͼ2��ʾװ�ã��缫��Ϊ���Ե缫��������SO2 �� �������ų�����Һ������NO2 ��
�������ĵ缫��ӦʽΪ ��
���ڼ��������£��������ų�����Һ����NO2 �� ʹ��ת��Ϊ�����壬ͬʱ��SO32�����ɣ��÷�Ӧ�����ӷ���ʽΪ ��
��3��һ�������¿��ü״���CO��Ӧ���ɴ�������CO��Ⱦ�������£���a molL��1�Ĵ�����b mol��L��1Ba��OH��2��Һ�������ϣ���ַ�Ӧ����Һ�д���2c��Ba2+��=c��CH3COO��������û����Һ�д���ĵ��볣��Ka=���ú�a��b�Ĵ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ClO2�Ǹ�Чɱ�����������ö��Ե缫���NaC1O3��Һ�Ʊ��ߴ�C1O2��ԭ������ͼ��ʾ������˵����ȷ���ǣ� �� 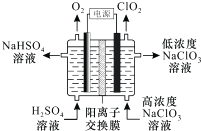
A.�������У�Na+���������ƶ�
B.��������O2��ClO2����ͬ�����µ������Ϊ1��1
C.�����ĵ缫��Ӧʽ��ClO3��+H2O+e��=ClO2��+2OH��
D.����ܷ�Ӧ�Ļ�ѧ����ʽ��4NaClO3+4H2SO4 ![]() O2��+4ClO2��+4NaHSO4+2H2O
O2��+4ClO2��+4NaHSO4+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ô��������ΪBaFe12O19���������״������������������ʯ(Y3Fe5O12)��Ϊ�����塣��(Y)��ϡ��Ԫ�أ���Ϊ��3�ۡ����ǵ������������Ԫ�صļ�̬ӦΪ (����)
A.ֻ�У�2��
B.ֻ�У�3��
C.��2�ͣ�3��
D.��2�ͣ�6��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com