
| A. | 物质发生化学反应都伴随着能量变化 | |
| B. | 伴有能量变化的物质变化都是化学变化 | |
| C. | 在一个确定的化学反应关系中,反应物的总能量与生产物的总能量有可能相同 | |
| D. | 如果旧化学键断裂吸收的能量大于新化学键形成释放的能量,则该反应为放热反应 |
分析 A.化学反应的实质为旧键的断裂和新键的形成,断裂化学键吸收能量,形成化学键放出能量,以此判断;
B..伴随能量变化的不一定是化学变化,如加热等;
B.反应可以是放热反应,也可以是吸热反应;
D.如果断键吸收的能量大于成键所放出的能量,则反应就是吸热反应,反之是放热反应.
解答 解:A.化学反应的实质为旧键的断裂和新键的形成,断裂化学键吸收能量,形成化学键放出能量,则物质发生化学反应都伴随着能量变化,故A正确;
B.化学反应的基本特征是伴随能量变化,但伴随能量变化的不一定是化学变化,故B错误;
B.反应可以是放热反应,也可以是吸热反应,所以反应物的总能量不一定高于生成物的总能量,故C错误;
D.根据化学变化的本质可知,如果断键吸收的能量大于成键所放出的能量,则反应就是吸热反应,反之是放热反应,故D错误.
故选A.
点评 本题考查了常见能量的转化形式、吸热反应和放热反应,为高频考点,注意一个化学反应属于吸热反应还是放热反应与反应的条件无关,旧化学键断裂吸收的能量与新化学键形成所释放的能量的相对大小决定了反应是放热还是吸热.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题

| A. | t1时减小了A(g)的浓度,增加了C(g)的浓度,平衡向逆反应方向移动 | |
| B. | t1时升高了温度,平衡向逆反应方向移动 | |
| C. | t1时增加了A(g)和B(g)的浓度,平衡向正反应方向移动 | |
| D. | t1时减小了压强,平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以2-氯丙烷为主要原料制备1,2-丙二醇[CH3CH(OH)CH2OH]时,依次经过的反应类型为消去反应-加成反应-取代反应 | |
| B. | 一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 | |
| C. | 有机物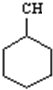 的一氯代物有4种 的一氯代物有4种 | |
| D. | 乙烷和丙烯的物质的量共1mol,完全燃烧生成3molH2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的能量一定高于N | |
| B. | 断开X、Y中的化学键吸收的能量大于形成M、N中化学键放出的能量 | |
| C. | X、Y的总能量一定高于M、N的总能量 | |
| D. | 因该反应是放热反应,故不加热一定可以反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X原子的电子层数比Y原子的电子层数多 | |
| B. | X的单质一定能将Y从NaY的水溶液中置换出来 | |
| C. | X的单质比Y的单质更容易与氢气反应 | |
| D. | X的氢化物水溶液的酸性一定比Y的氢化物水溶液的酸性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se是同一种核素 | |
| B. | ${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se互为同位素 | |
| C. | ${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se分别含有44和46个质子 | |
| D. | ${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se都含有34个中子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
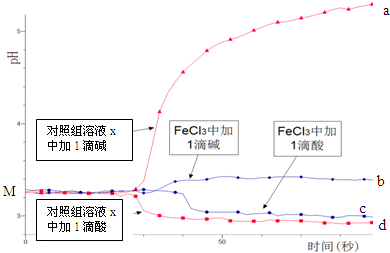
| A. | 依据M点对应的pH,说明Fe3+发生了水解反应 | |
| B. | 对照组溶液x的组成可能是0.003 mol/L KCl | |
| C. | 依据曲线c和d说明Fe3+水解平衡发生了移动 | |
| D. | 通过仪器检测体系浑浊度的变化,可表征水解平衡移动的方向 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有氢氧化钠 | B. | 碳酸钠和氢氧化钠 | ||
| C. | 碳酸氢钠和氢氧化钠 | D. | 只有碳酸钠 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com