
【题目】已知:2A(g)+3B(g)![]() 2C(g)+zD(g),现将2mol A与3mol B混合于2 L的恒容密闭容器中,若反应进行2 s,A的转化率为40%,测得v(D)=0.2 mol·L-1·S-1,下列有关该反应的说法错误的是( )
2C(g)+zD(g),现将2mol A与3mol B混合于2 L的恒容密闭容器中,若反应进行2 s,A的转化率为40%,测得v(D)=0.2 mol·L-1·S-1,下列有关该反应的说法错误的是( )
A.z=2
B.2s末,反应物B的浓度为0.9mol·L-1
C.若反应再经2s达平衡,则平衡时生成物D的浓度为0.8mol·L-1
D.反应达平衡时,反应物A、B的分子数之比为2:3
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】实验装置如下图所示。先关闭K,使A中的反应进行,加热玻璃管C,可观察到C管中发出耀眼白光,产生白烟,管壁上附着有淡黄色物质。实验完成后,将C管中固体全部加入盐酸中,有臭鸡蛋气味的气体生成。请回答下列有关问题:
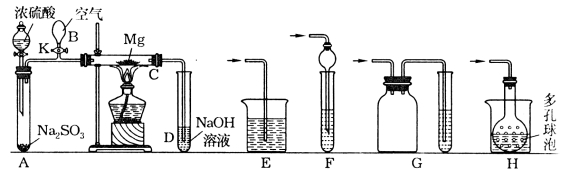
(1)C中全部产物有 、 、 。
(2)本实验先使A中反应进行,再加热C装置,其目的是 。
(3)停止实验时,先打开K,再停止滴加浓硫酸,熄灭酒精灯,橡胶气胆B在实验中的作用是 。
(4)若无装置B、K,使用普通导管,本实验的尾气吸收装置可以选用上图中装置 (填写序号,多选扣分)。
(5)C中的Mg应放在不锈钢垫片上而不能直接接触管壁的原因是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学反应速率的说法中,正确的是( )。
A.化学反应速率是指某一时刻、某种反应物的瞬时反应速率
B.化学反应速率为0.8 mol·L-1·s-1指反应1 s时某物质的浓度为0.8 mol·L-1
C.根据化学反应速率的大小可以推知化学反应的快慢
D.对于一个化学反应来说,其反应速率越大,反应现象就越明显
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容密闭容器中,能够表明反应A(s)+3B(g)![]() 2C(g)+D(g)已达平衡的是( )
2C(g)+D(g)已达平衡的是( )
①混合气体的压强不变;
②混合气体的密度不变;
③B的物质的量浓度不变;
④容器内B、C、D三种气体的浓度比为3:2:1;
⑤混合气体的相对分子质量不变;
⑥消耗3molB的同时生成2molC
A.①②③ B.②③④ C.②③⑤ D.①③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下实验能成功的是
A.将卤代烃和氢氧化钠溶液混合加热,充分反应后再加入硝酸银溶液观察沉淀的颜色判断卤素原子
B.将铁屑、溴水、苯混合制溴苯
C.在苯酚溶液中滴入少量稀溴水出现白色沉淀
D.将铜丝在酒精灯上加热变黑后,立即深入无水乙醇中,铜丝恢复成原来的红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用地壳中某主要元素生产的多种产品在现代高科技中占有重要位置,足见化学对现代物质文明的重要作用。例如:光导纤维的主要成分是 ;目前应用最多的太阳能电池的光电转化材料是 ;
(2)某气态氧化物的化学式为XO2,在标准状况下,1.92 g 该氧化物的体积为672 mL,则该氧化物的摩尔质量为 _____。
(3)某无色溶液X,由K+、NH4+、Ba2+、Al3+、Fe3+、CO32-、SO42-中的若干种离子组成,取该溶液进行如下实验:
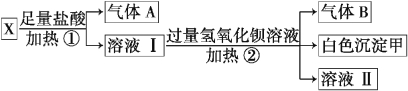
(1)白色沉淀甲是________。
(2)试写出实验过程中生成气体B的离子方程式 _________________________。
(3)通过上述实验,可确定X溶液中一定存在的离子是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某天然有机化合物A仅含C、H、O元素,与A相关的反应框图如下:
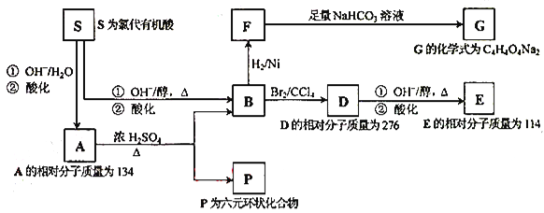
(1)写出A、P、E、S的结构简式
A: 、P: 、E: 、S: 。
(2)写出在浓H2SO4存在并加热的条件下,F与足量乙醇反应的化学方程式:
。
(3)写出与D具有相同官能团的D的所有同分异构体的结构简式:
①
②
③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。回答下列问题:
(1) NaClO2的化学名称为____________。
(2)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×103mol·L1。反应一段时间后溶液中离子浓度的分析结果如下表。
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式 。增加压强,NO的转化率________________(填“提高”、“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐___________(填“增大”“不变”或“减小”)。
③由实验结果可知,脱硫反应速率___________脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________。
(3)不同温度下,NaClO2溶液脱硫、脱硝反应中,SO2和NO的平衡分压Pe如图所示。
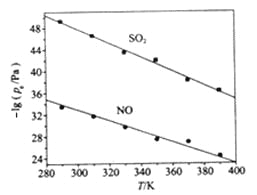
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均____________(填“增大”、“不变”或“减小”)。
②反应ClO2+2SO32===2SO42+Cl的平衡常数K表达式为___________。
(4)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是_______。
②已知下列反应:
SO2(g)+2OH(aq)===SO32(aq)+H2O(l) ΔH1
ClO(aq)+SO32(aq)===SO42(aq)+Cl(aq) ΔH2
CaSO4(s)===Ca2+(aq)+SO42(aq) ΔH3
则反应SO2(g)+ Ca2+(aq)+ ClO(aq) +2OH(aq) ="==" CaSO4(s) +H2O(l) +Cl(aq)的ΔH= _。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com